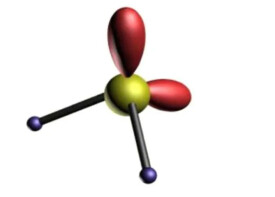
價電子對數
分子中存在孤對電子對的數量
價電子對數,指的是分子中存在孤對電子對的數量。
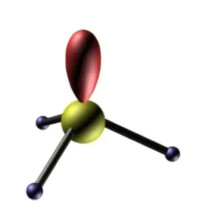
價電子對數
分子中的價電子對(包括成鍵電子對n,和孤電子對m)由於相互排斥作用,儘可能趨向彼此遠離以減小斥力。
【注意】如果分子中存在孤對電子對,由於孤對電子對比成鍵電子對更靠近原子核,它對相鄰成鍵電子對的排斥作用較大,因而使相應的鍵角變小。
價電子對數計算
(1)價電子對數=成鍵電子對n + 孤電子對m
(2)成鍵電子對n=與中心原子成鍵的原子個數
(3)
(4)陽離子在分子上減去所帶電荷數 陰離子在分子上加上所帶電荷數

價電子對數
價電子對數與雜化軌道空間構型關係
| 2 | 3 | 4 | 5 | 6 | |
| 雜化軌道空間構型 | 直線形 | 平面三角形 | 正四面體 | 三角雙錐 | 正八面體 |
推斷分子空間構型的具體步驟
⑴、先確定中心原子的價層電子對數,再確定雜化軌道的空間構型
直線形
平面三角形
正四面體
⑵、確定中心原子的孤對電子對數,推斷分子的空間構型。
① 若孤電子對數為0,則分子的空間構型和雜化軌道的空間構型相同
② 若孤電子對數不為0,則分子的空間構型和雜化軌道的空間構型不同。
| 分子 | ||||||
| 價電子對數 | 2 | 2 | 3 | 4 | 4 | 4 |
| 雜化軌道構型 | 直線形 | 直線形 | 正三角形 | 正四面體 | 正四面體 | 正四面體 |
| 有無孤對電子 | 無 | 無 | 無 | 無 | 有 | 有 |
| 分子空間結構 | 直線形 | 直線形 | 平面三角形 | 正四面體 | V形 | 三角錐形 |
推斷離子空間構型的方法
對於ABm型分子(A是中心原子,B是配位原子),分子中的價電子對數可以用下式計算:
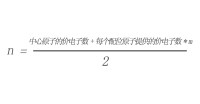
公式圖
注意:
①中心原子的價電子數等於中心原子的最外層電子數。
雜化類型與軌道空間構型及分子構型的關係
| 雜化類型 | 雜化類型 | 雜化軌道空間構型 | 分子空間構型 |
| sp雜化 | SP | 直線形 | 直線形 |
| sp2雜化 | SP2 | 平面正三角形 | 平面三角形 V形 |
| sp3雜化 | SP3 | 正四面體形 | 正四面體形 三角錐形 V形 |
小結:
對於ABm型分子,若價電子對數與配位原子數目相等,則分子的空間構型與雜化軌道的空間構型相同。
若價電子對數與配位原子數目不等,則中心原子的孤電子對影響分子的空間構型。
含碳原子軌道雜化方式的判斷
看中心原子有沒有形成雙鍵或叄鍵,如果有1個叄鍵,則其中有2個π鍵,用去了2個p軌道,形成的是sp雜化;如果有1個雙鍵則其中有1個π鍵,形成的是sp2雜化;如果全部是單鍵,則形成的是sp3雜化。即:每個碳原子的雜化軌道數=碳原子所成的σ鍵數。
具有相同價電子數(指全部電子總數或價電子總數)和相同原子數的分子或離子具有相同的結構特徵。符合等電子原理的分子或離子稱為等電子體。