π鍵
肩並肩方式重疊所形成的化學鍵
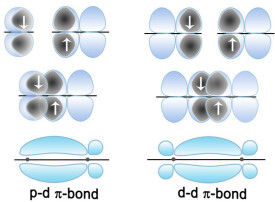
原子軌道垂直於鍵軸以“肩並肩”方式重疊所形成的化學鍵稱為π 鍵。形 成π 鍵時,原子軌道的重疊部分對等地分佈在包括鍵軸在內的平面上、下兩側,形狀相同,符號相反,呈鏡面反對稱。名字中的希臘字母π代表了p軌道,因為π鍵的軌道對稱性與p軌域相同。p軌道通常參與形成π鍵,然而,d軌道同樣能參與形成。
當兩個原子的軌道(p軌道)從垂直於成鍵原子的核間連線的方向接近,發生電子云重疊而成鍵,這樣形成的共價鍵稱為π鍵。π鍵通常伴隨σ鍵出現,π鍵的電子云分佈在σ鍵的上下方。σ鍵的電子被緊緊地定域在成鍵的兩個原子之間,π鍵的電子相反,它可以在分子中自由移動,並且常常分佈於若干原子之間。如果分子為共軛的π鍵體系,則π電子分佈於形成分子的各個原子上,這種π電子稱為離域π電子,π軌道稱為離域軌道。某些環狀有機物中,共軛π鍵延伸到整個分子,例如多環芳烴就具有這種特性。
由於π電子的電子云不集中在成鍵的兩原子之間,所以它們的鍵合遠不如σ鍵牢固,因此,它們的吸收光譜出現在比σ鍵所產生的波長更長的光區。單個π鍵電子躍遷所產生的吸收光譜位於真空紫外區或近紫外線區;有共軛π鍵的分子,視共軛度大小而定,共軛度小者其π電子躍遷所產生的電子光譜於紫外線區,共軛度大者則位於可見光區或近紅外線區。
例如,px與px軌道對稱性相同的部分,若以“肩並肩”(側面)的方式,沿著x軸的方向靠近、重疊,其重疊部分對等地處在包含鍵軸(這裡指x軸)的xy平面上、下兩側,形狀相同而符號相反,亦即對xy平面具有反對稱性,這樣的重疊所成的鍵,即為π鍵。形成π鍵的電子叫π電子。
π鍵的重疊程度比σ鍵小,所以π鍵不如σ鍵穩定。當形成π鍵的兩個原子以核間軸為軸作相對旋轉時,會減少p軌道的重疊程度,最後導致π鍵的斷裂。
根據分子軌道理論,兩個原子的p軌道線性組合能形成兩個分子軌道。能量低於原來原子軌道的成鍵軌道π和能量高於原來原子軌道的反鍵軌道π,相應的鍵分別叫π鍵和π*鍵。分子在基態時,兩個p電子(π電子)處於成鍵軌道中,而讓反鍵軌道空著。
(1)兩個p軌道形成一個π鍵儘管π鍵本身弱於σ鍵,但是π鍵仍然和σ鍵並存於多鍵中,因為合併的鍵比他們分別都要強。這一點從通過比較乙烷(154 pm)、乙烯(133 pm)、乙炔(120 pm)的鍵長就可以看出。
(2)從原子軌道重疊程度來看, π鍵 的 重 疊 程 度 要 比σ 鍵 的 重 疊 程 度 小,因 此π 鍵的鍵能要小於σ 鍵的鍵能,所 以 鍵 的 穩 定 性 低 於σ 鍵,鍵電子比σ 鍵電子活潑,是化學反應的積極參與者。
(3)當兩個原子形成共價單鍵時,原子軌道總是沿鍵軸方向達到最大程度的重疊,所以單鍵都是σ鍵;形成共價雙鍵時,有一個σ鍵和一個π 鍵 ;形成共價叄鍵時 ,有一個σ 鍵和兩 個 TT鍵。
1、2個原子或多個原子共平面;
2、原子都提供平行的軌道;
3、提供的電子總數小於軌道數的2倍。
定域π鍵:有機分子中只包含σ鍵和孤立π鍵的分子稱為非共軛分子。這些σ鍵和孤立π鍵,習慣地被看成是定域鍵,即組成σ鍵的一對σ電子和孤立π鍵中一對π電子近似於成對地固定在成鍵原子之間。這樣的鍵叫做定域鍵。例如,分子的任何一個C-H σ鍵和分子的π鍵,其電子運動都局限在兩個成鍵原子之間,都是定域鍵。
離域π鍵:在這類分子中,參與共軛體系的所有π電子的遊動不局限在兩個碳原子之間,而是擴展到組成共軛體系的所有碳原子之間。這種現象叫做離域。共軛π鍵也叫離域鍵或非定域鍵。由於共軛π鍵的離域作用,當分子中任何一個組成共軛體系的原子受外界試劑作用時,它會立即影響到體系的其它部分。共軛分子的共軛π鍵或離域鍵是化學反應的核心部位。
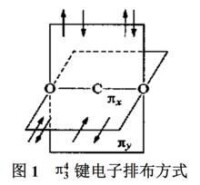
:氮分子中,2個N原子各用1個p軌道上的1個電子形成σ鍵后,剩餘的2個互相垂直的p軌道兩兩平行,形成2個鍵。
π鍵
為等電子體,也有類似的結構。
π鍵並不一定要連接幾個原子,金屬原子和氫分子的σ鍵間的π交互作用在一些有機金屬化合物的還原中扮演了很重要的角色。炔和烯中的π鍵經常與金屬結合,所成的鍵含有很高的Π成分。