離域鍵
離域鍵
當分子中總的價電子對數目少於鍵的數目時,就會形成缺電子多中心鍵。例如,在乙硼烷中有兩個B─H─B橋式兩電子三中心鍵。缺電子多中心鍵常導致形成環狀或籠形分子結構。當電子對的數目超過可能形成的定域鍵數時,會出現富電子多中心鍵。例如,在XeF中存在四電子三中心鍵。π配鍵是配體的π電子向受體配位形成的(見配位化合物)。例如在中,乙烯的π電子向鉑原子配位,形成三中心鍵。夾心鍵是指夾心絡合物中存在的共軛π 鍵向中心離子的配位鍵。最早發現的夾心絡合物是二茂鐵Fe(CH),其中鐵和兩個茂環之間存在夾心鍵。共軛π 鍵是在三個以上原子中心之間形成的大π鍵。苯是典型的包含共軛π鍵的分子,其中有遍及六個碳原子的大π鍵。
具有離域鍵的分子不可能用唯一的只含定域鍵的結構式表示。從定域鍵形成離域鍵,能使體系的能量降低,降低的這部分能量稱為共軛能或離域能。
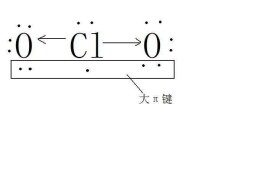
1.定義:在多原子分子中如有相互平行的p軌道,它們連貫重疊在一起構成一個整體,p電子在多個原子間運動形成π型化學鍵,這種不局限在兩個原子之間的π鍵稱為離域π鍵,或大π鍵。
2.形成大π鍵的條件:
①這些原子都在同一平面上;②這些原子有相互平行的p軌道;③p軌道上的電子總數小於p軌道數的2倍。
大π鍵是3個或3個以上原子形成的π鍵,通常指芳環的成環碳原子各以一個未雜化的2p軌道,彼此側向重疊而形成的一種封閉共軛π鍵。
例如,苯的分子結構是六個碳原子都以sp2雜化軌道結合成一個處於同一平面的正六邊形,每個碳原子上餘下的未參加雜化的p軌道,由於都處於垂直於苯分子形成的平面而平行,因此所有p軌道之間,都可以相互重疊而形成以下圖式,苯的大π鍵是平均分佈在六個碳原子上,所以苯分子中每個碳碳鍵的鍵長和鍵能是相等的。
又如,1,3-丁二烯分子式為個碳原子均與3 個原子相鄰,故採用sp2雜化。這些雜化軌道相互重疊,形成分子σ骨架,故所有原子處於同一平面。每個碳原子還有一個未參與雜化的p軌道,垂直於分子平面,每個p軌道裡面有一個電子,故丁二烯分子中存在一個“4軌道4電子”的p-p大π鍵。通常用bπa 來表示,其中a為平行的p軌道的數目,b表示平行p軌道里電子數。
3.分類:
離域π鍵:在這類分子中,參與共軛體系的所有π 電子的遊動不局限在兩個碳原子之間,而是擴展到組成共軛體系的所有碳原子之間。這種現象叫做離域。共軛π鍵也叫離域鍵或非定域鍵。由於共軛π 鍵的離域作用,當分子中任何一個組成共軛體系的原子受外界試劑作用時,它會立即影響到體系的其它部分。共軛分子的共軛π鍵或離域鍵是化學反應的核心部位。
定域π鍵:有機分子中只包含 σ 鍵和孤立π 鍵的分子稱為非共軛分子。這些σ 鍵和孤立π 鍵,習慣地被看成是定域鍵,即組成σ 鍵的一對σ 電子和孤立π 鍵中一對π 電子近似於成對地固定在成鍵原子之間。這樣的鍵叫做定域鍵。例如,CH分子的任一個鍵和分子的π 鍵,其電子運動都局限在兩個成鍵原子之間,都是定域鍵。
不飽和的化合物中,有三個或三個以上互相平行的p軌道形成大π鍵,這種體系稱為共軛體系。共軛體系中,π電子云擴展到整個體系的現象稱為電子離域或離域鍵。
共軛效應:電子離域,能量降低,分子趨於穩定,鍵長平均化等現象稱為共軛效應,也叫做C效應。
共軛效應的結構特點:共軛體系的特徵是各σ鍵在同一平面內,參加共軛的p軌道軸互相平行,且垂直於σ鍵在的平面,相鄰p軌道間從側面重疊發生鍵離域。共軛效應與誘導效應相比還有一個特點是沿共軛體系傳遞不受距離的限制。
烷基上C原子與極小的氫原子結合,由於電子云的屏蔽效力很小,所以這些電子比較容易與鄰近的π電子(或p電子)發生電子的離域作用,這種涉及到σ軌道的離域作用的效應叫超共軛效應。超共軛體系,比共軛體系作用弱,穩定性差,共軛能小。
π-π共軛
通過形成π鍵的p軌道間相互重疊而導致π電子離域作用稱為共軛。參加共軛的原子數目等於離域的電子總數,又稱為等電子共軛。我們可以簡單地概括為雙鍵,單鍵相間的共軛就是π-π共軛。例如: 共軛體系的分子骨架稱做共軛鏈.
共軛體系
通過未成鍵的p軌道(包括全滿,半滿及全空軌道)與形成π鍵的p軌道的重疊而導致的電子離域作用,稱為共軛。包括富電子,足電子,缺電子三種p-π共軛類型。我們也可以簡單地理解為:雙鍵相連的原子上的p軌道與π鍵的p軌道形成的共軛即為p-π共軛。
σ-π超共軛
丙烯分子中的甲基可繞鍵旋轉,旋轉到某一角度時,甲基中的鍵與的π鍵在同一平面內,鍵軸與π鍵p軌道近似平行,形成共軛體系,稱為超共軛體系。
在研究有機反應時有著重要的應用,在學習不對稱烯烴的HX加成反應時,我們以C正離子形成的穩定性來解釋馬爾科夫尼科夫規則,若應用σ-π超共軛效應,則不僅說明甲基是推電子的,同時加深了對這一經驗規則的深入理解。再如,不飽和烯烴的a-H的特殊活潑性也可以用超共軛效應來理解。丙烯的甲基比丙烷的甲基活潑的多,在液氨中丙烯中甲基的H易被取代,丙烷中甲基的H不易被取代。
超共軛