價電子
化學反應時能夠用於成鍵的電子
價電子指原子核外電子中能與其他原子相互作用形成化學鍵的電子,為原子核外跟元素化合價有關的電子。過渡元素的價電子不僅是最外層電子,次外層電子及某些元素的倒數第三層電子也可成為價電子。價電子同時亦決定該元素的電導性能。一般來說,原子的價電子數愈少,活性就愈高。
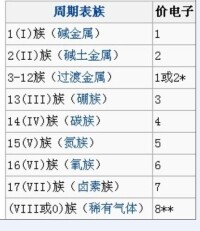
主族元素的價電子就是主族元素原子的最外層電子;過渡元素的價電子不僅是最外層電子,次外層電子及某些元素的倒數第三層電子也可成為價電子,如有時也包括次外層的D電子,對於鑭系元素,還有倒數第三層的F電子,可通過原子軌道能量判斷:ns<(n-2)f<(n-1)d
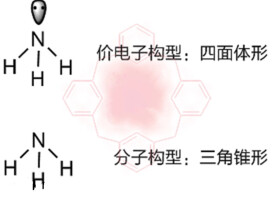
價電子是原子在參與化學反應時能夠用於成鍵的電子,是原子核外跟元素化合價有關的電子。在主族元素中,價電子數就是最外層電子數。副族元素原子的價電子,除最外層電子外,還可包括次外層電子。例如,鉻的價電子層結構是3d54s1,6個價電子都可以參加成鍵。鑭系元素還能包括外數第三層的4f電子。價電子全部參與成鍵,元素表現最高的正化合價;部分參加成鍵,就有多種化合價的特性。例如,鉻元素的最高化合價是+6價,此外有+5、+4、+3、+2、+1價等。在非金屬的主族元素中,除了第二周期元素外,一般都有nd空軌道。當這些元素跟電負性更大的元素化合時,原先最外層上的價電子可拆開進入nd軌道中,然後通過軌道雜化使這些元素表現較高的化合價。
1個CO2中含的價電子數為4+6×2=16個。
1個N2中含的價電子數為5x2=10個

價電子

價電子
一原子最外層電子殼的價電子支配原子的化學鍵作用。因此,相同價電子數的原子在元素周期表被放置於同一列。一般來說,原子的價電子數愈少,活性就愈高。所以1族鹼金屬非常活潑,該族包括了鋰、鈉及鉀,它們是金屬中活性最高的一群。
每一個原子,如果有滿原子價的話都穩定得多,換句話就是活性會低得多。實現這個有兩個方式:一個原子可以跟鄰近原子分享電子,一條共價鍵,或者從其他原子中移走電子,一條離子鍵。另一種離子鍵需要一原子把它的一些電子送給另一個原子;這也可以,因為把整個外層送出就能剩下滿原子價。通過移動電子,兩原子就連結起來了。這就是化學鍵,而且就提它們把原子建成分子及離子化合物。共有三種主要的化學鍵和一種大小比化學鍵略小的分子間作用力:
離子鍵
共價鍵
配位鍵(這是一種特殊的共價鍵,由一個原子提供兩個電子)
氫鍵(這是一種分子間作用力)
價電子同時亦決定該元素的電導性能。
目錄