含量均勻度檢查法
含量均勻度檢查法
除另有規定外,片劑、膠囊或注射用無菌粉末每片(個)標示量小於10mg或主葯含量小於每片個重量的5mg;其它製劑,每個標示量小於2mg或主葯含量小於每個重量2者,均應檢查含量均勻度。
復方製劑僅檢查符合上述條件的組分。
凡檢查含量均勻度的製劑,不再作重(裝)量差異的檢查。
必要性
含量均勻度是考察製劑工藝水平的重要指標之一。以前是用裝(重)量差異來衡量的。但隨著科學技術的發展及臨床要求,裝(重)量差異檢查不能滿足對小劑量製劑質量控制的要求。重(裝)量差異是檢查主葯和輔料的總限度,沒有明確考察主葯的均一性,而主葯是起治療作用的,尤其是對那些治療劑量與中劑量比較接近的品種,控制其含量均勻度顯得尤為重要。
含量均勻度檢查法首次運用在藥典中控制藥品質量是USPⅩⅦ版''BP1980開始收載該法''中國藥典1985年版收載。但各國藥典對含量均勻度檢查法的具體規定不盡相同。USP從ⅩⅦ版到ⅩⅩ版採用的為計數型二次抽樣檢驗方案,ⅩⅪ''ⅩⅫ採用計數-計量混合型二次抽樣檢驗方案在原有基礎上''增加了計量參數──相對標準偏差RSD;BP由1980版的一次抽樣法改為1988年的二次抽樣,BP、JP曾經把含量測定的均值而不是標示量作為參考值;中國藥典1985年版為一次抽樣計數型檢驗方法,從1990年版改為二次抽樣計量型檢驗方案''這也是目前上較為通用的方案。
從含量均勻度檢查法在各國藥典的發展狀況看,經歷了從計數型→計量型,一次抽樣→二次抽樣,以含量均值作參考值→以標示量作參考值的變化。
一個隨機抽樣檢查法的準確性不能用實測數據評價,只有用計算機產生廢品率不同、總體均值和標準差系統組合的製劑樣中單劑的模擬測定值,其數目可大至以百萬計,再用計算機按待評價的含量均勻度檢查法判定各模擬樣本是否合格,並累加判為合格的樣本數,以求出該檢查法對廢品率不同的製劑的接受概率,並用蒙特卡洛即統計模擬方法繪製OC曲線才能完成。
給定廢品率的產品按某種方案抽樣檢驗后判為合格品概率接收概率是一定的。以接收概率對產品的廢品率作圖所獲得的連續曲線稱為OC曲線。
OC曲線越陡''抽樣檢查法的判定準確度越高。
抽樣檢查有錯判的可能,但錯判率的大小是極為重要的,在製劑的含量均勻度檢查中,降低錯判率意味著使含量均勻度符合要求的製劑以更大的概率被判為合格,使含量均勻度不符合要求的以更小的概率被判為合格。在減小抽樣檢查錯判率的有效途徑中,最簡單的是一次增大樣本容量。樣本容量越大,準確度越高;樣本容量越小,準確度降低。但樣本容量的增大,工作量也相應增大。如何在保證判斷準確度的情況下,減小工作量,也是應該解決的問題之一。一次抽樣不能解決這對矛盾,而二次抽樣既保證了判斷的準確程度,又在樣本容量上有所改善,更能滿足實際工作的需要。
減小含量均勻度檢查錯判率的另一有效途徑,是把計數型改為計量型的判斷方法。計數型方法未能充分利用全部化驗數據提供的信息,是不夠合理的,效率也是不高的,而計量型則克服了這些缺點,它對所得數據的利用更為充分,使得到相同結果判定所需的樣本量減小,還能根據製劑生產水平的提高細緻的調整參數,以提高檢查法對製劑含量均勻度的質量要求和判定準確度;能扣除隨機性方法誤差對含量均勻度的影響等。
供試品初試10片個''複試20片片
取供試品按各該品種項下規定的方法測定
供試品的主葯必須溶解完全,必要時可用乳缽研磨或超聲波處理,促使溶解,並定量轉移至容量瓶中;
測定時''溶液必須澄清,如過濾不清,可離心后,取澄清液測定;
用uv法測定時''所用溶劑需一次配夠''當用量較大時''即使是同批號的溶劑也應混合均勻后使用;
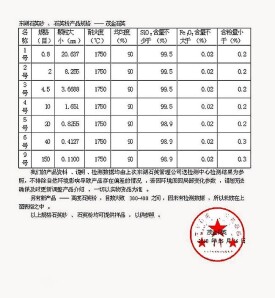
61應記錄檢測方法''所用儀器型號''以及每片個的測定結果並計算
62當含量測定方法與含量均勻度檢查所用方法不同時''而且含量均勻度未能從響應值求出每片個含量的情況下''用係數校正法計算。
Ⅰ:AS150Ⅱ:A18S150Ⅲ:A145S150
陰影區:複試區
如A+18S≤15符合規定
如A+S>15不符合規定
如A18+S≤15''且A+S≤150''則另取20片個複試''根據初、複試結果計算30片個的X''S和A''若A+1.45S≤15''判為符合規定''若A+1.45S>15''則判為不符合規定。
如該品種項下規定含量均勻度的限度為±20或其它百分數時,應將上述判定式中的15改為20或其它相應數值''但係數不變。
西藥藥材