Beckmann重排
Beckmann重排
醛肟或酮肟在酸性條件下發生分子內重排,得到取代醯胺的反應叫貝克曼(Beckmann)重排。貝克曼重排反應(Beckmann rearrangement)指醛肟或酮肟在酸催化下生成N-取代醯胺的親核重排反應,反應中起催化作用的酸常用五氯化磷。此反應是由德國化學家恩斯特·奧托·貝克曼發現並由此得名。
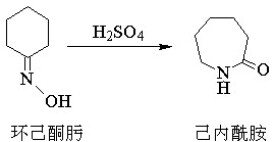
該反應在工業上有重要應用,環己酮與羥胺反應得到環己酮肟后可重排得到己內醯胺,此為尼龍-6的單體。手性基團在重排過程中保持光學活性。
重排反應
貝克曼重排是立體專一性反應。在酮肟分子中發生遷移的烴基與離去基團(羥基)互為反位。在遷移過程中遷移碳原子的構型保持不變,例如:
重排方程式
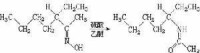
酮肟在酸性催化劑如硫酸、五氯化磷等作用下重排成取代醯胺的反應,稱為Beckmann(貝克曼)重排反應。
Beckmann重排反應是最著名的由C→N的重排,其重排特點不在於遷移基團的性質,例如相對的供電子能力(如前面討論過的重排),而是決定於它們的立體化學排列,即在不對稱酮肟的重排過程中只有與羥基處於反位的基團才能遷移到氮上(反式重排),並且遷移基團從離去基(HO)的背面經橋式中間體通過協同反應實現重排的。其反應歷程可表示如下:
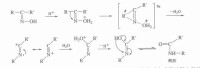
反應歷程
貝克曼(Beckmann)重排是指在酸性條件下,醛肟或酮肟的肟羥基質子化成易離去基團,然後與肟羥基反位的鄰近基團遷移,同時離去基團離去,產生鄰碳的正中心,繼而與反應介質中的親核試劑(如水)發生水合、脫質子化生成亞胺,再烯醇式-酮式互變而生成N-取代的醯胺。在重排中氮氧鍵的斷裂與反位基團的遷移是同步發生的。
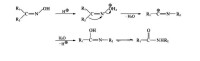
重排機理
Beckmann重排中,催化劑、反應溫度及溶劑對反應速度、收率、醯胺異構體的比例有很大影響,一般來說,極性溶劑和較高的溫度都能加速反應。重排反應是一級反應,所以極性溶劑可加快反應進行,溶劑的極性愈強,重排反應進行得愈快。反應介質的酸度與重排反應的速度也有關係,酸性越強,肟酯越易離去負離子,因而重排速度越快。
1.酸性條件和溶劑作用
酸性試劑的作用是使酮肟的羥基轉換成活性很好的離去基團,有利於氮氧鍵的斷裂。歸納起來,常見的酸性試劑有以下幾類。
(1)無機質子酸類:HSO,HCl,PPA。
(2)有機酸類:三氟磺酸,乙酸。
(3)Lewis酸類:BF,AlCl,ZnCl,HgCl。
(4)氯化劑或醯氯類:SOCl,PCI,PhSOCl,POCl。
(5)混合試劑類:PhP-CCl,HPO-AcO。
(6)其他類:Zeolite-α,Zeolite-β。
重排反應
由於醛肟在重排條件下易失水形成腈,所以一般不採用醛肟製備甲醯胺。在酮肟的結構中若含有酸敏感的基團,可以吡啶(或三乙胺)為溶劑,以醯氯或Lewis酸為催化劑進行重排反應。脂環酮肟進行重排發生擴環反應,生成內醯胺結構。
脂環酮肟的重排反應
3.Beckmann重排立體化學特徵
(1)烴基的遷移是立體專一的。由於遷移的基團只能從羥基背面進攻缺電子的N原子,因此,烴基的遷移為反位遷移。因酮肟有順式(Z)和反式(E)兩種幾何異構,由上述貝克曼重排機理可見,與氮上的羥基處於反位的烴基遷移佔優勢。但當以質子酸作催化劑時,遷移往往不具有立體專一性。
(2)如果遷移基團為手性碳原子,其遷移后的手性在重排中不受影響,仍保留原有構型。
聚醯胺纖維俗稱尼龍6,最早的尼龍製品是尼龍制的牙刷的刷子,婦女穿的尼龍襪。該材料具有最優越的綜合性能,包括機械強度、剛度、韌度、機械減震性和耐磨性,加上良好的電絕緣能力和耐化學性,使尼龍6 成為一種“通用級”材料,用於機械結構零件和討維護零件的製造。
瓦格納-邁爾外因重排反應(Wagneer-Meerwein rearrangement)
拜耳-維利格氧化重排反應(Baeyer-Villiger oxidation rearrangement)
捷米揚諾夫重排反應(Gemiyangnouf rearrangement)
氫過氧化物重排反應(hydroperoxide rearrangement)
頻哪醇重排反應(pinacol rearrangement)
苯偶醯重排反應(benzil rearrangement)
達金反應(Dakin reaction)
氰尿醯氯輔助貝克曼反應
氰尿醯氯和氯化鋅形成助催化劑可以催化貝克曼反應。例如:環十二酮能被平穩地轉化為對定的內醯胺,後者是生產尼龍12的單體。
此反應的反應機理是以循環型催化為基礎的,在循環中,氰尿醯氯通過親核芳香取代活化羥基。通過Meisenheimer絡合物中間體,最終生成產物。
異常貝克曼重排反應
α-二酮、α-酮酸、α-叔烴基酮(反式)、α-二烷基氨基酮、α-羥基酮和β-酮醚生成的肟在路易斯酸或質子酸的作用下斷裂為腈及相應的官能團化合物。這個反應稱為“異常貝克曼重排”,又稱非正常貝克曼重排;二級貝克曼重排;貝克曼斷裂反應等。
反應物為環己酮並生成己內醯胺。因為己內醯胺是製造尼龍6的重要原料,所以此反應也是貝克曼重排的一個很重要的應用。貝克曼溶劑被廣泛用來催化重排反應,其實際成分為乙酸,鹽酸和乙酸酐。也可以其他種類的酸催化,例如硫酸和多磷酸。在實際工業製造醯胺的流程中,通常使用的是硫酸,因為用氨進行中和處理后可以得到硫酸銨,後者是一種重要的化肥,能為土壤提供氮和硫。
由於Beckmann重排的原子轉化率高達100%,所以它屬於原子間經濟性的反應。目前,該反應已較多地應用於藥物合成中,成為綠色化學的反應類型之一。
1.合成醯胺類藥物及藥物中間體
通過Beckmann重排反應可以達到在藥物分子中引入醯胺結構的目的,以延長藥物的作用時間、減小藥物毒性等。
例如苯酚經過乙醯化、肟化和Beckmann重排反應可合成撲熱息痛。先用HF催化苯酚和乙酸酐的乙醯化,再與羥胺硫酸鹽進行肟化反應,所得酮肟在SOCl催化下,在乙酸乙酯溶劑中進行Beckmann重排反應,得目標產物N-乙醯基-對氨基苯酚。重排反應時加入少量的KI是為抑制副反應。
2.合成芳胺類藥物
應用Beckmann重排反應能以較高收率合成某些難製取的芳胺。例如,去氫松香酸甲酯因在溫和條件下可進行硝化,得6,8-二硝基化合物,因此不能經芳環硝化再還原引入—NH。但若採用Friedel-Crafts醯基化反應,則得到的幾乎完全是6-乙醯基衍生物。該衍生物在吡啶中與NHOH ·HCl反應得酮肟,再經Beckmann重排可生成88%的乙醯芳胺ArNH-COCH。(只有約4%的ArCONHCH),水解后即可得芳胺。
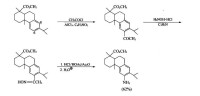
芳胺類藥物合成