光學誘導
光催化原理
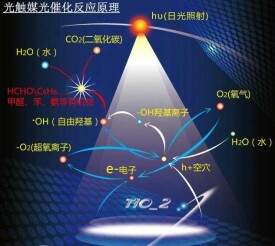
光學誘導是基於光催化劑在紫外線照射下具有的氧化還原能力而凈化污染物,也被稱為“光催化”。
光催化技術作為一種高效、安全的環境友好型環境凈化技術,對室內空氣質量的改善已得到國際學術界的認可。
1967年藤島昭教授在一次試驗中發現光催化反應,光催化技術是一種在能源和環境領域有著重要應用前景的綠色技術,在光的照射下可將有機污物徹底降解為二氧化碳與水,同時光催化材料自身無損耗,被環保界認為是21世紀環境凈化領域的革命性突破,被譽為“當今世界最理想的環境凈化技術”。
光催化原理
光催化凈化是基於光催化劑在紫外線照射下具有的氧化還原能力而凈化污染物。利用光催化凈化技術去除空氣中的有機污染物具有以下特點:
1直接用空氣中的氧氣做氧化劑,反應條件溫和(常溫 常壓)
2可以將有機污染物分解為二氧化碳和水等無機小分子,凈化效果徹底。
3半導體光催化劑化學性質穩定,氧化還原性強,成本低,不存在吸附飽和現象,使用壽命長。
光催化凈化技術具有室溫深度氧,二次污染小,運行成本低和可望利用太陽光為反應光源等優點,所以光催化特別合適室內揮發有機物的凈化,在深度凈化方面顯示出了巨大的應用潛力。
常見的光催化劑多為金屬氧化物和硫化物,如Tio2, ZnO,CdS,WO3等,其中Tio2的綜合性能最好,應用最廣。自1972年Fujishima和Honda發現在受輻照的Tio2上可以持續發生水的氧化還原反應,併產生H2以來,人們對這一催化反應過程進行了大量研究。結果表明,Tio2具有良好的抗光腐蝕性和催化活性,而且性能穩定,價廉易得,無毒無害,是目前公認的最佳光催化劑。該項技術不僅在廢水凈化處理方面具有巨大潛力,在空氣凈化方面同樣具有廣闊的應用前景。
1 烯烴的光異構反應與光重排反應
烯烴參與的光化學反應很多,烯烴的光異構反應與光重排反應主要有一下五類反應。
1.1 光誘導順反異構化反應
烯烴的光誘導順反異構化反應是非常普遍的光化學反應,在有機合成以及製藥工業中有一些成功的實例,如:在維生素D2類化合物的合成中將反式的化合物前提光異構生成順式的維生素D2衍生物。
1.2 光誘導價鍵異構化反應
光誘導價鍵異構化反應可方便合成香料或貯能化合物。如:降冰片二烯在電子轉移或三重態光敏劑存在下,光誘導價鍵異構反應生成貯能化合物四環烷。
1.3 雙-(π-甲烷)重排反應
這類反應很複雜,如1,4-戊二烯類化合物可發生雙-(π-甲烷) 重排反應,生成乙烯基環丙烷類化學物。
1.4 光誘導δ遷移重排反應
δ遷移反應是指共軛烯烴體系中一端的δ鍵移位到另一端,同時協同發生π鍵的移位過程,這一過程也經過環狀過渡態,但δ遷移的結果不一定生成環狀化合物。根據H原子從碳鏈上轉移的位置,有[10,12]、[10,14]、[10,16]等類型的δ遷移。
1.5 周環反應
有許多合成實例,其中麥角固醇或7-去氫膽固醇的光照單重態開環反應可分別合成預維生素D2和D3是利用光化學技術最為成功的例子。預維生素D2或D3進一步發生[10,16]δ遷移重排反應得到維生素D2或D3。由於光化學次級反應的發生,反應產物很複雜,為高產率得到預維生素D2或D3,直到目前這一反應仍然吸引著光化學家們研究興趣。
2 光誘導的環合加成
2.1 光誘導[2+2]環加成反應
烯烴有著非常豐富的光化學,其中光誘導的[2+2]環加成反應研究最為普遍。光誘導[2+2]環加成反應可同時引入四個手性中心生成環丁烷,具有很高的轉換效率;環丁烷進一步可發生斷鍵、擴環或縮環反應。因此,在合成化學、機理研究、生物模擬等方面都有應用價值。反應在分子間與分子內都能發生;共軛雙鍵、非共軛雙鏈、羰基與其它雜原子的π2體繫上都能進行這種反應,有非常多的合成與應用實例。如:呋喃類化合物通過[2+2]環加成反應合成一個四元環狀化合物。
2.2 雜環雙鍵[4+4]光環合加成反應生成交叉環合物
3 烯烴的光氧化反應
自然界中有陽光和氧存在的地方都有光氧化反應的發生。特別是在光敏劑的存在下,使得光氧化反應更加豐富多彩。光氧化反應的研究在生物學、醫學、有機物的降解等方面都有重要的意義,在有機合成上也佔有特別重要的位置。Sch- enck將光敏氧化反應分成兩類,即通過電子或質子轉移的稱Ⅰ型反應;通過能量轉移產生單重態氧(1O2)發生的反應稱Ⅱ型反應。
1O2的氧化反應具有高度的區域與空間選擇性,往往是天然產物合成中的關鍵步驟。上述產物很難用熱化學方法合成,這些產物進一步轉換的產物在合成化學同樣很有意義。
3.1 烯烴與單線態氧的[1+2]環加成反應
1O2可以與烯烴發生[1+2]環加成反應,生成的1,2-二氧環丁烷,保持原有的立體構型。除了少數共軛烯烴外,能夠發生這種反應的多半是雙鏈上帶有雜原子取代基的富電子烯烴,如烯胺、烯醚、烯硫醚等。生成的二氧雜環丁烷一般不穩定,易於分解為相應的羰基化合物。
3.2 1O2與烯烴的[1,3]加成反應(“ene”反應)
1O2與烯烴的[1,3]加成反應伴隨著從3位上的奪氫反應,產物仍為烯烴,因此稱“ene”反應。氧與烯烴的加成與奪氫,總是發生在同面,具有立體專一性,反應不發生消旋,沒有E/Z異構化產生,在合成上很重要。
1O2“ene”反應氧化產物為烯丙基過氧化氫不穩定,一般還原為相應的醇后,再行分離提純。烯丙基過氧化氫的轉換產物在合成上也會有用。在一些特殊烯烴為反應物時“ene”反應氧化產物還可能是環氧化物或其它過氧化物。“ene”反應在合成上不乏應用實例,如利用1O2“ene”反應可使雙鍵移位,由α-蒎烯轉化生成β-蒎烯,中間產物無需分離提純,總產率達42%。這是當前文獻報道中產率高,且較簡便的轉化方法。
3.3 共軛二烯與單線態氧的[1+4]環加成反應