離子晶體結構
離子晶體結構
多數鹽類鹼類和金屬氧化物的晶體結構都是離子晶體結構。典型的離子晶體是元素周期表中I A族的鹼金屬元素Li,Na,K,Rb,Cs和VI A的鹵族元素F,CI,Br,I之間形成的化合物晶體。
離子晶體是以正負離子為結合單元的,其結合鍵為離子鍵。因此,離子晶體結構很大程度上取決於正、負離子如何堆垛成為具有最大靜電引力和最小靜電斥力的狀態。
Pauling在實驗基礎上,用離子鍵理論,歸納總結出離子晶體的如下結構規則。
2)電價規則。在一個穩定的離子晶體結構中,每個負離子的電價等於或接近等於與之鄰接的各正離子靜電鍵強度的總和。
3)負離子多面體共用頂、棱和面的規則。在一配位結構中,共用棱特別是共用面的存在,會降低這個結構的穩定性。對於電價高,配位數低的正離子來說,這個效應尤為顯著。
4)不同種類正離子配位多面體間連接規則。在含有一種以上正離子的離子晶體中,一些電價較高,配位數較低的正離子周圍的負離子配位多面體之問有盡量互不結合的趨勢,傾向於共頂連接。
5)節約規則。在同一晶體中,同種正離子與同種負離子的結合方式應最大限度地趨於一致,即晶體中配位多面體的類型力圖最少。
離子晶體結構多種多樣。按化學式分類,二元離子晶體,有AB型、AB型和AB型之分,其中AB型中有型(屬立方晶系)、型(屬立方晶系)、閃鋅礦型(型,屬立方晶系)和纖鋅礦型型,屬六方晶系)4種基本結構類型;AB型中則有型(屬立方晶系)和金紅石(,屬四方晶系)型2種基本結構類型;AB型中則有剛玉()型,屬三方晶系結構。多元化合物中有ABO型(鈣鈦礦,屬立方-正交晶系)結構和ABO,型(,尖晶石,屬立方晶系)結構。
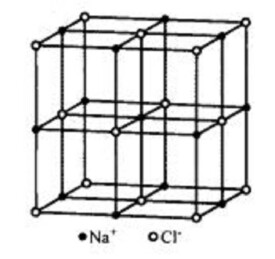
最典型的離子晶體結構是NaCl 型,自然界有幾百種化合物都屬於此種結構,有氧化物;氮化物;碳化物等;所有的鹼金屬硫化物和鹵化物(除外)也都具有這種結構。它屬於立方晶系,空間群,可以看成分別由Na和CI構成兩個fcc結構相互在棱邊上穿插而成,Na 和的半徑比為0. 525,Na 位於Cl 形成的八面體空隙中,其中每個Na 被6個CI 包圍,反之CI 也被等數量的Na 包圍。每個晶胞的離子數為8,即4個Na 和4個CI 。
陶瓷材料中的晶相大多屬於離子晶體。離子晶體是由正負離子通過離子鍵按一定方式堆積起來而形成的。由於離子鍵的結合力很大,所以離子晶體的硬度高、強度大、熔點和沸點較高、熱膨脹係數較小,但脆性大;由於離子鍵中很難產生可以自由運動的電子,所以離子晶體都是良好的絕緣體;在離子鍵結合中,由於離子的外層電子比較牢固地束縛在離子的外圍,可見光的能量一般不足以使其外層電子激發,因而不吸收可見光,所以典型的離子晶體往往是無色透明的。離子晶體的這些特性在很大程度上取決於離子的性質及其排列方式。
硅酸鹽晶體結構的基本特點:
(1)構成硅酸鹽的基本結構單元是硅氧四面體。硅氧之間的結合除離子鍵外,還有相當數量的共價鍵。
(2)按電價規則,每個氧最多只能為兩個硅氧四面體所共有。
(3)按鮑林第三規則,硅氧四面體中未飽和的氧離子和金屬正離子結合后,可以相互獨立地在結構中存在,或者可以通過共用四面體頂點彼此連接成單鏈雙鏈或成層狀網狀複雜結構,但不能共棱和共面連接,否則結構不穩定,且同一類型硅酸鹽中,硅氧四面體間的連接方式一般只有一種。
(4)硅氧四面體中的硅氧結合鍵通常並不是一條直線,而是呈鍵角為145°的折線。總之,硅酸鹽晶體結構是由硅氧四面體結構單元以不同方式相互聯結而成,有孤島狀組群狀。鏈狀層狀和骨架狀結構等,其結構頗為複雜。