na
化學元素鈉
徠鈉是一種金屬元素,在周期表中位於第3周期、第ⅠA族,是鹼金屬元素的代表,質地柔軟,能與水反應生成氫氧化鈉,放出氫氣,化學性質較活潑。鈉元素以鹽的形式廣泛的分佈於陸地和海洋中,鈉也是人體肌肉組織和神經組織中的重要成分之一。
伏特在19世紀初發明了電池后,各國化學家紛紛利用電池分解水成功。英國化學家戴維堅持不懈地從事於利用電池分解各種物質的實驗研究。他希望利用電池將苛性鉀分解為氧氣和一種未知的“基”,因為當時化學家們認為苛性鹼是氧化物。他先用苛性鉀(氫氧化鉀)的飽和溶液實驗,所得的結果卻和電解水一樣,只得到氫氣和氧氣。後來他改變實驗方法,電解熔融的苛性鉀,在陰極上出現了具有金屬光澤的、類似水銀的小珠,一些小珠立即燃燒併發生爆炸,形成光亮的火焰,還有一些小珠不燃燒,只是表面變暗,覆蓋著一層白膜。他把這種小小的金屬顆粒投入水中,立即冒出火焰,在水面急速奔躍,發出刺刺的聲音。就這樣,戴維在1807年發現了金屬鉀,幾天之後,他又從電解碳酸鈉中獲得了金屬鈉。
戴維將鉀和鈉分別命名為Potassium和Sodium ,因為鉀是從氫氧化鉀(Potash),鈉是從碳酸鈉(Soda)中得到的,它們至今保留在英文中。鉀和鈉的化學符號K、Na分別來自它們的拉丁文名稱Kalium和Natrium。

切割金屬鈉
已發現的鈉的同位素共有22種,包括鈉18至鈉37,其中只有鈉23是穩定的,其他同位素都帶有放射性。

金屬鈉的性質
4Na徠 + O= 2NaO (常溫)
2Na+O= NaO加熱或點燃)
2Na+2HO=2NaOH+H↑
2Na+2CO2 = Na2CO3+CO
2Na+2ROH=2RONa+H↑ (ROH表示低元醇)
2Na + 2NH= 2NaNH + H↑(此反應中“2NH”表示液氨)
鈉原子的最外層只有1個電子,很容易失去,所以有強還原性。因此,鈉的化學性質非常活潑,能夠和大量無機物,絕大部分非金屬單質反應和大部分有機物反應,在與其他物質發生氧化還原反應時,作還原劑,都是由0價升為+1價(由於ns 電子對),通常以離子鍵和共價鍵形式結合。金屬性強,其離子氧化性弱。鈉的相對原子質量為22.989770。
高中化學認為鈉鹽均溶於水,但實際上醋酸鈾醯鋅鈉、醋酸鈾醯鎂鈉、醋酸鈾醯鎳鈉、鉍酸鈉、銻酸鈉,鈦酸鈉皆不溶於水。
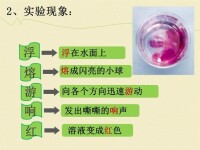
鈉與水反應
戴維是通過電解法首先製得的金屬鈉,隨後幾十年內,工業上採用鐵粉和高溫氫氧化鈉反應的方法製備金屬鈉,同時得到四氧化三鐵和氫氣。電解氫氧化鈉也得到金屬鈉,但是此方法使用較少。當前工業上普遍採用氯化鈉-氯化鈣熔鹽電解法制金屬鈉。
化學方程式:
以氫氧化鈉為原料,放入鐵質容器,熔化溫度320~330℃,以鎳為陽極,鐵為陰極,在電極之間設置鎳網隔膜,電解電壓4~4.5V,陰極析出金屬鈉,並放出氧氣。再將製得的金屬鈉精製,用液體石蠟包裝。
化學方程式:
(在此實驗中由於熔融狀態的鈉的密度約為:0.968g/cm³,而熔融狀態下的氫氧化鈉的密度約為:2.130 g/cm³,所以最終產生的熔融狀態的鈉單質會浮在熔融的氫氧化鈉上,與空氣中的氧氣快速化合發生危險,所以要在稀有氣體的保護下進行此實驗,否則會發生危險!)
測定有機物中的氯。還原和氫化有機化合物。檢驗有機物中的氮、硫、氟。去除有機溶劑(苯、烴、醚)中的水分。除去烴中的氧、碘或氫碘酸等雜質。製備鈉汞齊、醇化鈉、純氫氧化鈉、過氧化鈉、氨基鈉、合金、鈉燈、光電池,製取活潑金屬。
鈉是人體中一種重要無機元素,一般情況下,成人體內鈉含量大約為3200(女)~4170(男)mmol,約佔體重的0.15%,體內鈉主要在細胞外液,佔總體鈉的44%~50%,骨骼中含量佔40%~47%,細胞內液含量較低,僅佔9%~10%。
1、鈉是細胞外液中帶正電的主要離子,參與水的代謝,保證體內水的平衡,調節體內水分與滲透壓。
2、維持體內酸和鹼的平衡。
3、是胰液、膽汁、汗和淚水的組成成分。
4、鈉對ATP(腺嘌呤核苷三磷酸)的生產和利用、肌肉運動、心血管功能、能量代謝都有關係,此外,糖代謝、氧的利用也需有鈉的參與。
5、維持血壓正常。
6、增強神經肌肉興奮性。
人體鈉的主要來源為食物。鈉在小腸上部吸收,吸收率極高,幾乎可全部被吸收,故糞便中含鈉量很少。鈉在空腸的吸收大多是被動性的,在迴腸則大部分是主動的吸收。鈉與鈣在腎小管內的重吸收過程發生競爭,故鈉攝入量高時,會相應減少鈣的重吸收,而增加尿鈣排泄。因尿鈣丟失約為鈣瀦留的50%,故高鈉膳食對鈣丟失有很大影響。
高溫、重體力勞動、經常出汗的人需要注意補充鈉(飲用淡鹽水等)。
鈉普遍存在於各種食物中,一般動物性食物高於植物性食物,但人體鈉來源主要為食鹽、以及加工、製備食物過程中加入的鈉或含鈉的複合物(如谷氨酸、小蘇打等),以及醬油、鹽漬或腌制肉或煙熏食品、醬鹹菜類、發酵豆製品、鹹味休閑食品等。
人體內鈉在一般情況下不易缺乏、但在某些情況下,如禁食、少食,膳食鈉限制過嚴而攝入非常低時,或在高溫、重體力勞動、過量出汗、腸胃疾病、反覆嘔吐、腹瀉使鈉過量排出而丟失時,或某些疾病,如艾迪生病引起腎不能有效保留鈉時,胃腸外營養缺鈉或低鈉時,利尿劑的使用而抑制腎小管重吸收鈉時均可引起鈉缺乏。鈉的缺乏在早期癥狀不明顯,倦怠、淡漠、無神、甚至起立時昏倒。失鈉達0.5g/kg體重以上時,可出現噁心、嘔吐、血壓下降、痛性吉爾痙攣,尿中無氯化物檢出。
正常情況下,鈉攝入過多並不蓄積,但某些特殊情況下,如誤將食鹽當食糖加入嬰兒奶粉中餵養,則可引起中毒甚至死亡。急性中毒,可出現水腫、血壓上升、血漿膽固醇升高、脂肪清除率降低、胃黏膜上皮細胞受損等。鈉的適宜攝入量(AI)成人為2200mg/d。

保存在煤油中的鈉
在純度要求不高的少量保存時可用煤油浸泡,如實驗室保存。
貯於陰涼乾燥處,遠離火種、熱源。少量一般保存在液體石蠟中。
與氧化劑、酸類、鹵素分儲分運。
