嗜肝DNA病毒
病毒名稱
Hepadnaviridae,又稱肝去氧核糖核酸病毒科、肝病毒科,主要在脊椎動物中出現,並引起肝臟感染。
嗜肝DNA病毒的傳播指嗜肝DNA病毒科的病毒在其自然宿主人,猿,鳥之間的傳播,包括在種間與種內的傳播。
嗜肝DNA病毒科
Hepadnaviridae,又稱肝去氧核糖核酸病毒科、肝病毒科,有兩個屬:
正肝去氧核糖核酸病毒屬:Orthohepadnavirus, 又稱正肝病毒屬; 代表種:乙型肝炎病毒(Hepatitis B virus,HBV),簡稱乙肝病毒。
鳥類肝去氧核糖核酸病毒屬:Avihepadnavirus, 又稱禽肝病毒屬;代表種:鴨乙型肝炎病毒(Duck Hepatitis B virus,DHBV)。
嗜肝DNA病毒屬於雙鏈DNA反轉錄病毒,其具有獨特的逆轉錄複製策略,非常小的基因組(約3.0~3.2 kb),和非常狹窄的宿主範圍和組織嗜性的特點。
病毒粒子結構形態
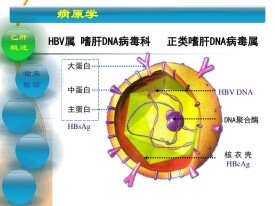
以人類乙肝病毒患者為例,在感染者病人血清中有三種不同形態的顆粒,分別為大球形顆粒(直徑約42nm)、小球形顆粒(直徑約22nm)和管形顆粒(直徑約22nm), 圖表1,是HBV病毒粒子大球型顆粒中抗原的簡單結構圖,臨床醫學中常用檢測表面抗原(HBsAg),表面抗原抗體(抗-HBs),核心抗體(抗-HBc),e抗原(HBeAg),e抗體(抗HBe),這五項的陰陽性來估測乙肝病毒攜帶者者的患病情況。
大球型顆粒為完整的病毒粒子,由外衣殼和核心組成,也稱為丹娜顆粒(Dane),1970年由丹娜發現。外衣殼相當於一般病毒的包膜,由脂質雙層和蛋白質組成。脂質雙層內含有乙肝表面抗原(HBsAg),分別是S抗原、前S1(preS1)和前S2(preS2)抗原,它們一起又構成了外殼上大、中、小三種蛋白形式. 核心又分為外部的衣殼和內部雙鏈DNA:衣殼由乙肝病毒的核心抗原(HBcAg)組成,呈二十面體對稱,直徑約為27納米,也稱為內衣殼;DNA上還帶有DNA多聚酶,DNA呈環狀並且有缺口並含有約3200個核苷酸;DNA的功能是編碼表面抗原,核心抗原,和DNA多聚酶。小形球顆粒,直徑大約22納米,是乙肝病毒感染后血液中最多見的一種,它由表面抗原組成,並不含有乙肝病毒的DNA以及DNA聚合酶。管形顆粒,直徑也約為22納米,長度在50~70納米之間,實際上是由幾個小球形顆粒聚合在一起而成,同樣具有表面抗原的抗原性。由於小球形顆粒和管形顆粒均由病毒的包膜蛋白構成,不含病毒基因組,因而不具有如大球型顆粒的感染性,被稱為亞病毒顆粒。
基因結構
以HBV 的病毒粒子的基因組為例,粒子核心內部有雙連DNA。正鏈不完整,且不能編碼病毒蛋白,長度約為負鏈的三分之一。負鏈有四個開放區(ORF),分別稱為S(ORF S)、C(ORF Core)、P(ORF P)及X(ORF X),能編碼全部已知的HBV蛋白質。S區可分為S基因和前S基因,其中S基因能編碼主要表面蛋白,前S基因能編碼PreS1和PreS2蛋白。C區基因包括:前C基因,編碼e抗原(HBeAg);C基因,編碼核心抗原(HBcAg)。 P區約佔基因組75%以上,能編碼DNA多聚酶。X區能編碼鹼性多肽
病毒的複製
HBV基因組為雙鏈環形DNA,其複製過程有RNA逆轉錄病毒的特性,需要逆轉錄酶活性產生RNA/DNA中間體,再繼續進行複製。病毒粒子的複製大概過程為:
附著:病毒粒子附著在宿主細胞表面的受體后以內吞的方式進入細胞內。
侵入:病毒粒子包膜(外衣殼)與宿主細胞的細胞膜相融合,將病毒粒子核心部分釋放到細胞質。
脫殼:核心部分釋放基因並傳送到宿主的細胞核內,此期間病毒的部分雙鏈DNA轉為全雙鏈,並轉化為共價閉合環狀DNA(cccDNA)以作為病毒基因(mRNAs)的轉換模版。
複製:在此期間複製新的病毒基因組,核衣殼及核心蛋白,病毒DNA的聚合酶
裝配:部分病毒基因與其它蛋白部分集裝后成為子病毒粒子,部分病毒基因則會循環複製更多的病毒基因。
釋放:最後將成熟的子病毒粒子釋放到宿主細胞外。
家族親緣樹
嗜肝DNA病毒中,人類乙肝病毒(HBV)分為8個基因型(A到H),在猿類發現三類型:長臂猿(GiHBV),猩猩(Orangutan HBV),黑猩猩(Chimpanzee HBV);其他宿主還有兔猴(WMHBV),土撥鼠(WHV),地松鼠(GSHV)和北極地松樹(AGSHV)。鴨乙肝病毒屬的宿主有:蒼鷺(Heron virus),鶴(CHBV),鴨(DHBV),鸛(stock virus),羅斯鵝(RGHBV)。
正肝病毒屬
又稱正肝去氧核糖核酸病毒屬,主要感染對象是脊椎動物,這個屬的每一類病毒的宿主範圍都很窄小。代表型是乙型肝炎病毒,其自然宿主是人類。除了人類乙肝病毒,還在其他靈長類動物中存在幾個類型,如長臂猿 (gibbon), 猩猩 (orangutan), 黑猩猩(chimpanzee)。
如圖表6所示,諸多學者就在這些不同猿類中發現的正肝病毒進行了研究,並在人類乙肝病毒以及非人類乙肝病毒的起源上產生爭議,說法不一。
從現有的研究中正肝病毒屬分為四個原型種:人類乙肝病毒(HBV),土撥鼠肝炎病毒(WHV),地松鼠肝炎病毒( GSHV),兔猴肝炎病毒(WMHV)。因地理分佈和自然環境不同而發生突變,HBV獲得了8個基因型,A至H,以及在類人猿中發現的三個密切相關的基因型。HBV的8個基因型進一步至少可以分化成24亞型。相關學者從日本一位乙肝患者中分離出來一個新的基因型J,因其基因跟已知的人類和類人猿乙肝病毒基因型不同,定為了HBV類J型。
禽肝病毒屬
禽肝病毒屬的病毒主要感染鳥類,原型種是鴨乙肝病毒屬(DHBV),蒼鷺乙肝病毒 (HHBV)。其他種有鶴乙肝病毒 (CHBV),鸛乙肝病毒(STHBV),羅斯鵝乙肝病毒(RGHBV)。第一例禽肝病毒案例在家養的鴨子體內發現。
正肝病毒屬病毒與鴨乙肝病毒屬病毒的區別
1.核苷酸同源率低,基因組大小不同(正肝病毒屬約3.20 k,禽肝病毒屬約 3.0 kb)
2.正肝病毒屬病毒粒子核心蛋白大一些,丹顆粒和管型顆粒L型較多,小球型顆粒S型蛋白較多;禽肝病毒屬病毒粒子中L和S蛋白平均分佈於各粒子形態中,但沒有M型表面蛋白。
3.宿主範圍都很小,正肝病毒屬僅限於哺乳動物,禽肝病毒屬僅限於鳥類。
4.主要的傳播方式不同:正肝病毒屬病毒,在哺乳動物間主要通過水平傳播方式;禽肝病毒屬病毒主要通過垂直傳播。
人類之間的傳播
相關研究顯示,直到2000年,全球的急性乙肝病例超過520萬例,而慢性乙肝病則感染者約佔總人口的5%。乙肝病毒案例是全球性的存在,是肝炎病毒中最常見的一類,它會在人類的肝臟引起慢性和急性肝臟疾病,大大影響著全球人類的健康問題。一者這種長時間的慢性感染會引起多種肝臟疾病,包括脂肪肝、肝硬化,或者由於肝臟功能的喪失而引起死亡;二者慢性乙肝是引起肝癌的主要原因,全球大約60%到80%的肝癌病例都是由於長時間的慢性乙肝引起的;再者,在各種臨床研究以及各種治療方案的實施后,至今還沒有一種確切的方法可以治癒這類乙肝疾病,儘管有患者痊癒過,但為極少案例。大多數人一旦感染乙型肝炎病毒,並檢測患有乙肝疾病,則是終身疾病,或者是終身乙肝病毒攜帶者。所以乙肝病毒的傳播被大量的研究,通過注射疫苗而在一定程度內被控制著,但是由於存在各種的潛在行可能,跨物種傳染、病毒變種、種間及種內的基因重組、交叉感染,使得各種控制乙型肝炎病毒傳播的措施都面臨著挫折。
主要傳播途徑
乙肝病毒在人類的主要傳播途徑是腸外體液接觸,如血液和唾液(但感染的毒性因各種程度的乙肝疾病而不同);圍產期嬰兒與患者母親接觸。有人認為,在乙肝病毒感染率高的地區,如東亞、南亞以及撒哈拉沙漠以南的非洲,圍產期母親患者對嬰兒的傳染,以及這種終身病毒攜帶的狀態是高流行率的主要原因。還有案例發現,有乙肝表面抗原陽性的母乳的母親是病毒攜帶者,但是還沒有科學性的報道關於乙肝病毒通過母乳傳播。
水平傳播
1.直接的人與人接觸的傳播方式:接觸了感染了乙肝病毒患者的體液(唾液血液,陰道液和精液),如傷口類的體外接觸,性接觸,在就醫的過程中被感染的工作者傳染。
2.間接的傳播:如輸血型感染和醫療器具感染是在社會發展落後期間乙肝疾病爆發的主要原因,由於社會落後貧窮,為了生存而賣血,醫療衛生差,乙肝病毒泛濫傳播。 A.輸血及血液透析傳播:輸血傳播是乙肝傳播途徑中最常見的一種,如在輸血過程中被感染或輸入被感染的血源,但是隨著醫學的進步,此現象得以了有效控制,但是尚未杜絕。
B.醫源性傳播:醫源性傳播也就是說在就醫的過程中被感染,多數存在的是微量注射或接種而引起的感染,因此要特別注意注射、接種、紋身等使用的各種醫療器具。
垂直傳播 圍產期急性乙肝及攜帶乙肝表面抗原的母親可將乙肝病毒傳給新生兒,尤其攜帶乙肝表面抗原的母親為主要的感染源。
跨物種傳播
跨物種傳播還未被科學證實,但是如果這類型的傳播發生了,會擴大各病毒株的宿主範圍,降低各病毒株宿主特異性,為控制病毒的傳播加大了難度,也會使試圖通過免疫以降低乙肝病毒的感染的途徑變得更難實施。由於人類不斷侵入雨林靈長類動物棲息地中,加上試圖保護面臨滅絕危險的靈長類動物的,從而增加了野生靈長類動物和人類的互動接觸,正肝病毒的相互的跨物種轉播提供了可能性。在靈長動物之間的跨物種傳染已經發現過很多例了,這種跨物種之間的傳染,靈長類動物之間以及動物與人間的跨物種傳染,也給嗜肝DNA病毒株基因重組提供了很大的機會,更進一步的研究表明在靈長類動物中存在的各類嗜肝DNA病毒株有很大可能分享過同一古老的宿主。
非人類的哺乳動物之間的傳播
Gibbon HBV:長臂猿乙肝病毒,研究表明從長臂猿體內分離出來的乙肝病毒接種到大猩猩體內之後,導致了大猩猩感染急性肝炎;從大猩猩體內分離出的大猩猩乙肝病毒接種到長臂猿體內后也能引起同樣的效果。
Woolly mongkey HBV: 兔猴乙肝病毒,由於黑手蜘蛛猴和兔猴屬於同一科和亞科,所以相關研究選擇黑手蜘蛛猴作為研究兔猴乙肝病毒的模型,結果表明黑手蜘蛛猴易感染兔猴乙肝病毒,但是只能發展成隱性感染。還沒有大猩猩能感染上兔猴乙肝病毒的研究。
Woodchuck HBV: 土撥鼠乙肝病毒,只在東方土撥鼠(Marmota monax)中被檢測到,不會感染相關的高山狨(alpine marmosets)。但是有研究顯示含有土撥鼠乙肝病毒(WHV)衣殼的丁肝病毒(HDC)的wHDC可以感染大猩猩,以及初級的人類肝細胞。同樣,hHDC可以進入並感染土撥鼠體內的肝細胞,並且不用任何其他援助病毒的輔助,但是還沒有土撥鼠或土撥鼠初級幹細胞能感染人類乙肝病毒(HBV)的例子。
Ground squirrel HBV:地松鼠乙肝病毒,只感染土撥鼠和地松鼠,特別是松鼠的幾個物種(Spermophilus beecheyi andSpermophilus richardsoni),和系統發育密切相關的花栗鼠。但是當地松鼠乙肝病毒被接種到土撥鼠體內后,感染比較溫和,而且肝癌的爆發也會延遲。
人與動物之間的傳播
人類與類人猿存在著很多共同點,有同樣的祖先,所以有很大的可能性這些正肝病毒屬的病毒會在人類與類人猿之間相互傳播著、交叉感染,也會給不同病毒株提供基因重組的機會。人類乙肝病毒感染自然棲息地中類人猿的感染率是未知的,絕大多數關於類人猿感染上乙肝病毒的案例都是發生在用來作研究的捕獲動物中,包括在野外出生的和圈養出生的。人類乙肝病毒(HBV)只感染人類和種族親密的類人猿,如長臂猿,大猩猩,狒狒,一定程度上也會感染樹鼩,但是不能感染兔猴。地中海獼猴可以在體內初級肝細胞中複製HBV,但是這些動物對HBV的易感性還是未知的。
長臂猿 gibbon:相關研究表明在感染了HBV的類人猿中,HBV的傳播的根本途徑是垂直傳播。但是從長臂猿唾液中HBV的DNA檢測得知,水平傳播也有可能。如果這些健康的和感染HBV的長臂猿被圈養在相同區域里,他們很有可能通過性接觸以及其他水平傳播方式感染上HBV。
大猩猩 chimpanzee: 據相關研究,病毒性肝炎很早就存在於圈養的大猩猩,甚至在乙肝病毒發現之前就存在。所以以前許多研究都用大猩猩做為實驗模型來研究HBV,但是由於相關條例,大猩猩模型已被禁止使用。但是那些研究表示,在大猩猩體內,就HBV的DNA第一次複製后,複製的DNA就有感染性;而且大多數都發展成為類似於在人類中發生的急性肝炎,但是不會發展成為慢性肝炎疾病。
老鼠 mice:由於以類人猿等珍貴動物做研究模型被禁止,相關研究者開始使用老鼠做新的研究乙肝病毒的實驗模型。一些研究人員培養了轉基因小鼠,以研究乙肝病毒表面抗原的基因編碼表達,如preS,S和X的基因表達。結果是轉基因小鼠不易受HBV的感染,但患有重症聯合免疫缺陷(SCID)的小鼠可以感染並患上慢性肝病。此外,還發現在人類肝細胞中複製的乙肝病毒能夠在這些老鼠中迅速增殖.
這些人類乙型肝炎病毒能感染類人猿,或者能引起進一步傳播或發展為相應肝臟疾病的案例,可以給我們提供一點遐想。在類人猿中存在的HBV突變株,或者類人猿乙肝病毒也有可能感染人類,或者進一步發展為相關疾病,但是還沒有關於這類病毒感染人類相關報道。
總之,當涉及到血液等體液對感染源的暴露時,動物類疾病的傳播始終存在,並引起慢性感染或者急性感染,涉及到這些擁有家庭寵物,飼養員,以及屠夫等的情況。
禽肝病毒的傳播
鳥類之間傳播
DHBV:鴨乙肝病毒,只能感染一定種類的鴨和鵝,但是不能感染番鴨或雞,至少不能有效的感染。
HHBV:蒼鷺乙肝病毒,不能感染鴨,或者說只能沒有效的感染初級鴨肝臟細胞。有對在地理上孤立的不同蒼鷺種群進行的研究表明了橫向傳播的可能性,以及病毒的適應性和環境因素在一定程度上影響著HHBV的傳播,但是並不能確定HHBV是否普遍存在於生在在自然環境下的蒼鷺,儘管有跨種傳播的可能性。
CHBV:鶴乙肝病毒,從家族親緣關係上來看,相對於鴨,鶴與蒼鷺和鸛更親,但鶴乙肝病毒更能有效的感染鴨肝臟細胞,感染程度並與DHBV非常相似。
人類與鳥類之間的傳播
到目前為止,還沒有證據顯示禽肝病毒在鳥類與人之間的跨種傳播,但是禽肝病毒各病毒株的種間重組可以為這提供很大的潛在性可能,再加上許多鳥類還是人類主要食源之一,禽肝病毒株經過各種進化,不是沒有可能感染人類。
影響嗜肝DNA病毒傳播的原因
種屬特異性
特殊的基因複製方式賦予了這些病毒的特殊性,由於病毒逆轉錄酶的高複製能力和高錯誤率,使得嗜肝DNA病毒能很好的適應宿主,因為各類病毒在結構,蛋白及基因組上都有差異,所以他們的適應能力都不同,所以有了宿主特異性,限制著各類嗜肝DNA病毒的跨種傳播。
結構蛋白
L型蛋白的S1前區(Pre S1),是種屬特異性的存在關鍵,在一定程度上影響著病毒侵入宿主細胞過程中的‘附著’環節。有研究表明如果把這部分從乙肝病毒粒子上移去,乙肝病毒粒子的感染能力會降低。相對於M型蛋白來說,L型蛋白對病毒的感染能力貢獻更大。S型在一定程度上也能影響病毒進入宿主細胞,Pre S 也有潛在可能影響著跨種傳播。
潛在性可能
交叉感染和基因重組(種間和種內基因重組)都可以潛在的改變各類嗜肝DNA病毒的宿主範圍,甚至可以提高他們適應不同宿主的能力,或者適應不同的治療措施,提高抗藥性,進化出突變體,這些都能大大提高跨種傳播的可能性,也就打擊著我們今天對乙肝的預防及治療所做的各種努力。但是這些僅僅是潛在的可能,在這些可能性還沒有變成大量的事實之前我們應該採取更多的措施以減少嗜肝DNA病毒的傳播,以及預防各種可能性的跨種傳播。
交叉感染
有許多研究報告關於人類乙肝病毒(HBV)各基因型的交叉感染,包括HBV-A型和HBV-D型,HBV-A和HBV-G型,HBV-B型和HBV-C型。乙肝病毒感染普遍存在於亞洲,HBV-B和HBV-C型感染是主要的類型,C型比B型更能導致嚴重的感染癥狀。B型和C型交叉感染還會導致基因重組,重組后的病毒株可能比B型和C型更具治病能力。有報道稱,從對一些台灣年輕肝癌患者的研究中發現了基因型B與C之間重組菌株可能性。
基因重組
儘管嗜肝DNA病毒的宿主範圍都很小,但是在有跨種傳播潛在性可能的情況下,與基因重組相結合,宿主特異性很有可能會大大減小。存在於跨種傳播的種間重組為基因組變異提供了很大的可能性,不僅會改變病毒的病原性,還可以改變其傳播能力,並擴大宿主範圍。第一例記錄的關於潛在的基因重組案例發生在大猩猩乙肝病毒(Chimpanzee HBV)和人類乙肝病毒(HBV)之間。HBV與其他類人猿乙肝病毒株的重組,來自不同種宿主的長臂猿乙肝病毒株(GiHBV)之間重組,以及來自不同鳥類的禽肝病毒株的重組也被經實。
總之,這些種種的可能性都闡釋著人類在控制乙肝病毒的傳播中會面臨著巨大的挑戰。儘管通過各種治療手段(如注射疫苗),乙肝病毒的傳染得到了控制,但是在人口數量不斷暴增,人類活動不斷加劇與創新(挑戰自然極限),人與動物之間的互動加劇的情況下,如果不採取及時正確的應付措施,以上的可能就會變成事實,人類健康也將面臨著挑戰。