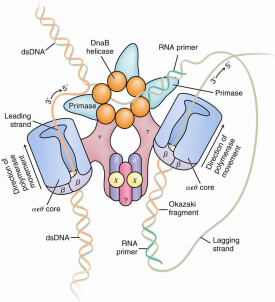
聚合酶(polymerase)又稱多聚酶。是專門生物催化合成脫氧核糖核酸(DNA)和核糖核酸(RNA)的一類酶的統稱。1957年,美國科學家阿瑟·科恩伯格(Arthur Kornberg)發現。
聚合酶結構圖
1957年,美國科學家阿瑟·科恩伯格(Arthur Kornberg)首次在
大腸桿菌中發現DNA聚合酶,這種酶被稱為DNA聚合酶I(DNA polymerase I,簡稱:Pol I)。1970年,德國科學家羅爾夫·克尼佩爾斯(Rolf Knippers)發現DNA聚合酶II(Pol II)。隨後,DNA聚合酶III(Pol III)被發現。
原核生物中主要的DNA聚合酶及負責染色體複製的是Pol III。
聚合酶醫學用途
可分為以下幾個類群:(1)依賴DNA的DNA聚合酶;(2)依賴RNA的DNA聚合酶;(3)依賴DNA的RNA聚合酶;(4)依賴RNA的RNA聚合酶。前兩者是DNA聚合酶,它使DNA複製鏈按模板順序延長。如在原核生物中僅就大腸桿菌中已被發現的就有三種(分別簡稱為PolⅠ,PolⅡ和PolⅢ等);DNA聚合酶只能在有引物的基礎上,即在DNA或RNA引物的3′-OH延伸,這DNA的合成方向記為5′→3′。換言之DNA聚合酶催化反應除底物(αNTP)外,還需要Mg2+ 、模板DNA和引物,迄今細胞內尚無發現可從單體起始DNA的合成。同樣,上述(3)和(4)是催化RNA生物合成反應中最主要的RNA合成酶,它們以四種三磷酸核糖核苷(NTP)為底物,並需有DNA模板以及Mn2 及Mg2 的存在下,在前一個
核苷酸3′-OH與下一個核苷酸的5′-P聚合形成3′,5′-磷酸二酯鍵,其新生鏈的方向也是5′→3′。RNA聚合酶也大量存在於原核和真核生物的細胞中。如大腸桿菌RNA聚合酶分子量4.8×105,由5條
多肽鏈組成,分別命名為α,α,β,β′,和γ,
全酶可用α2ββ′λ表示。真核生物RNA聚合酶分子大於5×105,由10~12個大小不等
亞基組成。聚合酶除作為自然界生命活動中不可缺少的組分外,在實驗室中大多用作生命科學研究的工具酶類之一。
聚合作用
聚合酶結構圖
在
引物 RNA'-OH末端,以dNTP為底物,按模板DNA上的指令由DNApolⅠ逐個將核苷酸加上去,就是DNApolⅠ的聚合作用。酶的專一性主要表現為新進入的
脫氧核苷酸必須與模板DNA配對時才有催化作用。dNTP進入結合位點后,可能使酶的構象發生變化,促進3'-OH與5'-PO4結合生成磷酸二酯鍵。若是錯誤的核苷酸進入結合位點,則不能與模板配對,無法改變酶的構象而被3'-5'外切酶活性位點所識別並切除之。
3'5'外切酶活性──校對作用
這種酶活性的主要功能是從3'→5'方向識別和切除不配對的DNA生長鏈末端的核苷酸。當反應體系中沒有反應底物dNTP時,由於沒有聚合作用而出現暫時的遊離現象,從而被3'→5'外切酶活性所降解。如果提高反應體系的溫度可以促進這種作用,這表明溫度升高使DNA生長鏈3'末端與模板發生分離的機會更多,因而降解作用加強。當向反應體系加入dNTP,而且只加放與模板互補的上述核苷酸才會使這種外切酶活性受到抑制,並繼續進行DNA的合成。由此推論,3'→5'外切酶活性的主要功能是校對作用,當加入的核苷酸與模板不互補而遊離時則被3'→5'外切酶切除,以便重新在這個位置上聚合對應的核苷酸。在某些
T4噬菌體突變株中DNA複製的真實性降低,而易發生突變,從此突變株分離得到的聚合酶的3'→5'外切酶活性很低。相反,另外一些具有抗突變能力的T4突變株中的聚合酶的3'→5'外切酶活性比野生型高得多,因此,其DNA複製真實性好,變異率低。可見,3'→5'外切酶活性對DNA複製真實性的維持是十分重要的。
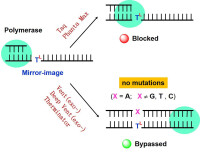
聚合酶分子反應示意圖
5'3'外切酶活性──切除修復作用
5'→3'外切酶活性就是從5'→3'方向水解DNA生長鏈前方的DNA鏈,主要產生5'-脫氧核苷酸。這種酶活性只對DNA上配對部份(雙鏈)磷酸二酯鍵有切割活力作用,方向是5'→3'。每次能切除10個核苷酸,而且DNA的聚合作用能刺激5'→3'外切酶活力達10倍以上。因此,這種
酶活性在DNA損傷的修復中可能起著重要作用。對岡崎片段5'末端DNA引物的去除依賴此種外切酶活性。
焦磷酸解作用
DNApolⅠ的這種活性可以催化3'末端焦磷酸解DNA分子。這種作用就是無機焦磷酸分解DNA生長鏈,可以認為是DNA聚合作用的逆反應,而且這種水解DNA鏈作用需要有模板DNA的存在。(dNMP)n XPPi←(dNMP)n-x X(dNPPP)→DNA
焦磷酸交換作用
催化dNTP末端的PPi同無機焦磷酸的交換反應。反應式為32P32Pi dNPPP←dNP32P32P PPi→DNA
最後兩種作用,都要求有較高濃度的
PPi,因此,在體內由於沒有足夠高的PPi而無重要意義。DNApolⅠ的DNA聚合酶活性和5'→3'外切酶活性協同作用,可以使DNA鏈上的切口向前推進,即沒有新的DNA合成,只有核苷酸的交換。這種反應叫缺口平移(Nicktranslation)。當雙鏈DNA上某個磷酸二酯鍵斷裂產生切口時,DNApoIⅠ能從切口開始合成新的NDA鏈,同時切除原來的舊鏈。這樣,從切口開始合成了一條與被取代的舊鏈完全相同的新鏈。如果新摻入的脫氧核苷酸三磷酸為α-32P-dNTP,則重新合成的新鏈即為帶有同位素標記的DNA分子,可以用作探針進行分子雜交實驗。
儘管DNApolⅠ是第一個被鑒定的DNA聚合酶,但它不是在
腸桿菌中DNA複製的主要聚合酶。主要證據如下:純化的DNApolⅠ催化dNTP摻入的速率為667鹼基/分,而體內DNA合成速率要比此高二倍數量級;大腸桿菌的一個突變株中,此酶的活力正常,但染色體DNA複製不正常;而在另一些突變株中,DNApolⅠ的活力中只是野生型的1%,但是DNA複製卻正常,而且此突變株增加了對紫外線、烷化劑等突變因素的敏感性。這表明該酶與DNA複製關係不大,而在DNA修復中起著重要的作用。
一些特定的DNA聚合酶對於化學修飾性核苷分子顯示出驚人的耐受性,從而為高度功能化的核酸分子的有效合成提供了令人激動的新機遇。
聚合酶結構示意圖
新興納米技術的一個誘人之處就是它可以識別核酸是否可作為一種用途多樣的有效實驗平台,以應用於建造那些更為複雜的
生物醫學工具。有多種特定的功能基團能以共價鍵的形式聯接到
核苷上,而核苷又依次通過幾種化學反應組裝成鏈狀物。一方面這是一種耗費勞動的過程,但在另一方面,一些科學家正通過此種過程來檢驗自然產生的酶類是否可以用作一種更為有效的替代物。
德國波恩大學的MichaelFamulok就是這樣的研究者。他的研究小組已經發表了幾篇文章介紹這種方法的可行性。最近,他們加大研究力度,使用七種不同的細菌性DNA聚合酶,系統檢測了包含有酸性、鹼性和親脂性之類的不同功能基團的多種核苷分子整合到寡核苷酸鏈的情況。一些酶很難對這些異化性底物產生作用,但Pwo和Vent這兩種聚合酶則與眾不同,它們能有效地將所有能檢測到的核苷變異分子進行有效整合。在隨後的實驗中,Famulok的研究小組描述了那些可能影響整合效率的模板順序決定簇;以這兩個包含所有四種核苷類型變異體的寡核苷酸聚合酶為例證,介紹了這些酶的高效合成;同時還介紹了為生產功能相近產物而對一種修飾性模板成功進行的
PCR擴增。
聚合酶分子反應示意圖
這些聚合酶的適應性對於將來開發諸如寡聚核苷酸適配子之類的生化工程產品具有重要的意義。Famulok解釋說:“這種新增化學特性也許能使寡聚核苷酸適配子獲得更多類似於蛋白質的活動特徵,而同時並沒有丟失它所擁有的類似核酸方面的優點。這對你希望使用寡聚核苷酸適配子作為診斷劑或藥物來說是非常有用的。”同時,他也希望將這種方法應用於有關高次DNA結構的複雜工程問題,例如,利用那些通過蛋白質交互作用的類似方式能進行自組裝的電荷分佈改變特徵,構建修飾性DNA分子。雖然這些工作還需要進一步完善,但同樣的原理也可以應用到RNA分子的功能化方面,為RNA小分子的良性管理提供新的可能。Famulok建議,“你可以將被束縛的鹼基以生化酶的時髦方式引入到RNA小分子中,接著試圖通過一個光脈衝或者其它類似的東西,激活這個RNA小分子。” Famulok最希望他的研究小組能為那些具有創新想法的研究者提供一種有價值的參考。他說:“如果人們想利用功能化的高密度DNA做些事情的話,雖然這些新思路我個人因為愚鈍還無法想象的話,但他們能在我們的論文中找到重要啟發,來幫助他們實現夢想。”
顯微鏡下的聚合酶
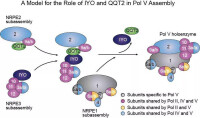
《自然》雜誌近日在線發表由中國科學院生物物理研究所研究員劉迎芳領導的研究組和南開大學
饒子和院士領導的南開大學—清華大學—生物物理所聯合研究組,共同完成的一項有關禽流感病毒聚合酶結構的研究,、揭示出流感病毒聚合酶關鍵部分PA亞基與PB1多肽複合體的精細三維結構,填補了禽流感病毒聚合酶結構領域研究的空白。這一結構的解析,為研究
禽流感病毒的複製機制,以及設計抗流感病毒的藥物提供了真實可用的模型。據介紹,
流感病毒基因組含有8個RNA片段,已知可以編碼11種病毒蛋白質。其中,由PA、PB1和PB2這3個亞基組成的聚合酶複合體是負責病毒基因組RNA複製以及病毒mRNA轉錄的關鍵組分,同時由於它的高度保守性、低突變率,成為抗流感病毒藥物設計的重要靶點。多年來的研究認為,PB1是病毒RNA聚合酶的催化亞基,負責病毒RNA的複製以及轉錄;PB2是負責以一種稱為“Snatch”的方式奪取宿主
mRNA的CAP帽子結構用於病毒mRNA轉錄;而PA亞基不但參與病毒複製過程,而且還參與病毒RNA轉錄、內切核酸酶活性、具有蛋白酶活性以及參與病毒粒子組裝等多種病毒活動過程,因而在整個聚合酶複合體的研究中顯得格外重要。研究人員利用全新的思路,解析了PA與PB1氨基端多肽蛋白複合體的2.9埃解析度晶體結構。該結構清晰顯示了PA與PB1多肽相互作用模式,發現該作用位點的
氨基酸殘基在流感病毒中高度保守,這為廣譜抗流感(包括人流感和禽流感)藥物研究提供了一個理想的靶蛋白。同時,根據該複合體結構以及已知的一些蛋白突變體研究結果,推測了PA亞基在聚合酶中的作用,為進一步研究提供了分子基礎。
迄今為止,在
真核細胞中已至少發現了12種DNA聚合酶,包括聚合酶α、β、γ、δ、ε、ζ、η、θ、ι、κ、λ和μ,它們通過參與DNA聚合反應核酸外切酶的校讀作用或DNA修復過程,對DNA複製保真度的維持起重要作用,直接影響著細胞遺傳的穩定性。