Fenton試劑
Fenton試劑
1894年,英國人H.J.H.Fenton首次研究表明,H2O2 在Fe 離子的催化作用下具有氧化多種有機物的能力。過氧化氫與亞鐵離子的結合即為Fenton試劑,其中Fe離子主要是作為同質催化劑,而H2O2 則起氧化作用。Fenton試劑具有極強的氧化能力,特別適用於某些難生物降解的或對生物有毒性的工業廢水的處理上,所以Fenton氧化法越來越受到人們的廣泛關注。

Fenton試劑
1894年,化學家Fenton首次發現有機物在(HO)與Fe組成的混合溶液中能被迅速氧化,並把這種體系稱為標準Fenton試劑,可以將當時很多已知的有機化合物如羧酸、醇、酯類氧化為無機態,氧化效果十分明顯。Fenton試劑是由HO和Fe混合得到的一種強氧化劑,特別適用於某些難治理的或對生物有毒性的工業廢水的處理。由於具有反應迅速、溫度和壓力等反應條件緩和且無二次污染等優點,近30年來,其在工業廢水處理中的應用越來越受到國內外的廣泛重視。
因其發音,又被稱之為“糞桶試劑”(非專業用語)。氧化機理
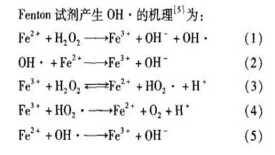
Jeseph指出Fe 和Fe 都能與H0反應。Fenton試劑反應過程如下:
(1) HO+ Fe→OH+ Fe+ ·OH
(2)Fe+ ·OH- →Fe+ OH
其中,產生·OH 的反應步驟(1) 控制了整個反應的速度,·OH通過反應方程(2) 與有機物反應而逐漸被消耗。
Fe能催化降解HO,使之變成O和HO,自由基鏈機理指出,對於單一的Fe系統(即除水外沒有其他的絡合物配位基),將產生·OH和HO。反應方程除(1) 、(2) 外,還有以下幾個步驟:
(3) HO + Fe→Fe-OOH+ H
(4) Fe-OOH →HO+ Fe
(5)HO+ Fe →Fe + HO
(6)HO+ Fe →Fe + O + H
(7)·OH + HO→HO+ HO
當HO 過量時,由於反應方程(4)的反應速度遠比反應方程(1) 的反應速度慢,所以[ Fe ]與[ Fe ] 的關係不大。反應方程(7) 指出了·OH消耗的另一途徑。通過分離有機化合物中的H、填充未飽和的C - C鍵,羥基·OH能不加選擇地同大多數有機物迅速反應,和·OH比較起來HO的反應活性微弱許多,而與之配對的O-幾乎沒有活性。當有O2 存在時,·OH與有機物反應產生的以碳為中心的自由基會與O反應,產生ROO·自由基,並最終變成氧化產物。除此之外,許多人提出了不同的Fe、PH、HO 反應途徑和中間產物。Kan提出Fenton 反應會產生被水包圍並與Fe 疏鬆連接的·OH,它能氧化大多數有機物。DAVIDA等很多研究提到高價鐵-氧中間產物,如FeO3 +,(L) Fe4 = O ,(L·+ ) Fe4 = O,L為有機絡和物,(L·+ )為帶一個電荷的有機絡和氧化物[2]。DAVIDA等[2]的研究指出,Fenton反應產生亞鐵離子,HO反應產生鐵水絡和物。
(8) [ Fe (HO)] + HO─→ [ Fe (HO)OH] + HO+
(9) [ Fe (HO)OH] + HO ─→ [ Fe (HO)(OH)] + HO+
當pH 為3~7 時,上述絡和物變成:
(10) 2 [ Fe (HO) OH]─→ [ Fe (HO) (OH) ] + 2 HO
(11) [ Fe (HO)(OH)] + HO ─→[ Fe(HO)(OH)] + HO
(12) [ Fe(HO)(OH)]+ [ Fe (HO)OH] →[ Fe(HO)(OH)]+ 2HO
以上反應方程式證明Fenton試劑具有一定得絮凝沉澱功能。Sheng H. Lin的研究表明, Fenton 試劑所具有的這種絮凝沉澱功能是Fenton試劑降解COD的重要組成部分。
因為Fe 在溶液中的存在形式受制於溶液的pH值,所以Fenton試劑只在酸性條件下發生作用,在中性和鹼性環境中,Fe不能催化H0產生·OH。研究者普遍認為,當pH值在2~4範圍內時,氧化廢水處理效果較好,最佳效果出現在pH=3時。Lin和Peng [10]在採用Fenton試劑處理紡織廢水時發現,當pH值增加並超過3時,廢水中的COD迅速升高,從而得到最優點pH=3。在該條件下,COD的去除率達到80%。
Casero將Fenton 試劑運用於芳香胺廢水處理時發現,O-聯茴香胺轉化成開環有機物的過程與起始pH值無關。反應完全后,廢水的pH值比起始pH值有所下降,原因可能是Fenton反應產物Fe水解使pH值下降。同時,Fenton試劑在較寬的pH值範圍都能降解有機物,這就避免了對廢水的緩衝。
試劑配比
在Fenton反應中,Fe起到催化劑的作用,是催化H0產生自由基的必要條件。在無Fe條件下,H0難於分解產生自由基。當Fe濃度很低時,反應(1)速度很慢,自由基的產生量小,產生速度慢,整個過程受到限制。當Fe濃度過高時,會將H0還原且被氧化成Fe,造成色度增加。
J.Yoon研究了不同[Fe]/[ H0 ] 比值對反應的影響。在[ Fe]/[ H0] = 2 環境中,當有機物不存在時,Fe在幾秒內消耗完。有機物存在時,Fe的消耗大大受到限制。但不管有機物存在與否,H0都在反應開始的幾秒內被完全消耗。這表明,在高[ Fe]/[ H0 ]比值條件下,消耗H0產生·OH自由基的過程在幾秒內進行完畢。在[ Fe2+ ]/[ H0 ] = 1環境中,當有機物不存在時,H0的消耗在反應剛開始時消耗迅速,隨後消耗速度緩慢。有機物存在時,H0 的消耗在反應剛開始時非常迅速,隨後完全停止。但不管有機物存在與否,Fe在反應剛開始后不久就被完全消耗。因此,反應開始時加入的Fe在90min內不能使H0消耗完。在[ Fe]/ [H0 ]≤1 條件下,和[Fe]/[ H0 ]=1時一樣,Fe在反應剛開始后不久就被完全消耗,但H0 被完全消耗的時間更長。
反應溫度
根據反應動力學原理,隨著溫度的增加,反應速度加快。但對於Fenton 試劑這樣的複雜反映體系,溫度升高,不僅加速正反應的進行,也加速副反應。因此,溫度對Fenton試劑處理廢水的影響複雜。適當的溫度可以激活·OH自由基,溫度過高會使H0分解成HO和O。Sheng[8]用Fenton試劑處理退漿廢水時發現,最佳的反應溫度出現在30℃,低於該溫度出水的COD迅速升高。這可能是由FeSO4/ H0的反應緩慢造成的。溫度高於30 ℃時,由於H0分解帶來的不良影響,COD去除率增加緩慢。Basu和Somnath用Fenton 試劑處理三氯苯酚時發現,溫度低於60 ℃時,溫度低反應出現正效果,高於60 ℃時,不利於反應的進行。以上研究者得出不同結果,可能是由於廢水成分不同造成的。
投加方式
正如前面所提,Fenton試劑在不同的Fe/ H0比值下具有不同的處理功能。FeSO大於H0時,Fenton試劑具有化學絮凝作用。當後者大於前者時,Fenton試劑具有化學氧化功能。因此,將整個反應過程分為兩步進行,兩步中考察不同的側重點,可能具有實際意義。有關實驗將Fenton試劑的一次投加(FeSO/ H0比值為400/1000) 和二次投加(FeSO/ H0 比值為300/100,100/900) 進行比較,結果發現,儘管反應進行到第二步時,COD的去除率仍有累積效應。但總的去除率並沒有明顯的提高。
動力學影響
Fenton 試劑化學氧化過程可用m級反應動力學模型表示;
Sheng H. Lin的研究發現,實驗結果能很好的用一級反應動力學模型表達。反應速率常數和溫度、FeSO和H0的初始濃度有關,而且和H0比較起來,Fenton氧化對FeSO的依賴更大。
此外,影響Fenton試劑處理程度的因素還有諸如有機物的濃度、停留時間、壓力等,因此,在工程實踐中需要綜合考慮多種因素以確定最佳的處理工藝,才能取得良好的經濟運行效果。
處理染料廢水
紡織印染廢水的組成複雜,是一種難降解的有機廢水,如何對其進行無害化處理一直受到研究者的關注。採用Fenton氧化技術處理印染廢水具有高效、低耗、無二次污染的優點。
葉招蓮和陳育紅採用Fenton氧化針對酸性大紅染料模擬廢水進行了處理研究。研究發現HO與 FeSO的比值在3~6(質量比)之間時COD的降解率最高。
顧平等對Fenton試劑處理活性黑KBR染料廢水進行了研究。研究結果表明,當染料濃度為400mg/L,雙氧水投量為0.4ml/L,硫酸亞鐵投量為300mg/L時,脫色率能達到96%,COD去除率為70%,最佳初始pH值為3。
處理苯、酚類廢水
酚類廢水廣泛存在於多種工業廢水中,這種廢水較難降解,且對微生物有毒害作用。在處理過程中,一般採用化學氧化法先對含酚廢水進行預處理以降解其毒性,然後再用生物處理,在所有的氧化工藝中,Fenton氧化苯類及酚類物質所需的時間最短,因而,可望在此類廢水的處理中得到廣泛應用。
Lou.J . C 等以苯、甲苯和二甲苯的混合物(BTX)作為模擬化合物進行Fenton反應試驗,結果表明:二甲苯可以用Fenton 法處理,當H0 :BTX:Fe = 12 :1:60 時,溶解的BTX可以在10min 內完全消失。
劉勇弟等用Fenton試劑處理含酚廢水得出pH值3~4左右,H0 的用量為COD 值的115倍理論量時處理效果較好。許多文獻報道[8,9,10]都認為,Fenton試劑氧化氯酚類物質的反應是以自由基反應歷程進行的。
處理垃圾滲濾液
隨著城市垃圾的不斷產生,垃圾滲濾液處理越來越引起人們的重視。城市垃圾滲濾液是一種組分複雜,可生化性差,水質變化很大的難處理廢水。由於其含有高度難降解有機物,因而不利於活性污泥法的運行。Fenton氧化法可以解決上述問題,它可以使帶有苯環、羥基、—COOH—SOH、—NO等取代基的有機化合物氧化分解,從而提高廢水的可生化性,降低廢水的毒性,改進其溶解性、沉澱性,有利於後續的生化或混凝處理。此外,Fenton試劑具有氧化迅速,溫度、壓力等條件緩和且無二次污染等優點而被廣泛應用。經研究發現,Fenton氧化法處理廢水時,主要將大分子的有機物氧化為小分子,從而降低垃圾滲濾液的COD。因此,Fenton氧化法對垃圾滲濾液中相對分子質量較小的有機物去除率不高。
處理工程用水
天津港油污水處理改造工程(主要處理南疆港區到港船舶排放的含油壓艙水、洗艙水和石化小區排放的含油生產廢水),Fenton法被用於混凝沉澱除鹽及去除COD的。中國工程物理研究院採用Fenton氧化法預處理放射性廢離子交換樹脂(鈾)可實現對717型、201×4型、201×7型3種常見含鈾放射性廢樹脂的完全分解,殘液中COD 的去除率達97 %以上,為放射性廢離子交換樹脂固化處理的前處理提供了一種新思路。研究發現,採用雙極電Fenton法處理船舶含油廢水,結果發現具有較高降解效果。Fenton法煉油廢水陰、非離子表面活性劑泡沫的去除也效果良好。
在飲用水中的應用
隨著飲用水原水水質的惡化及飲用水標準的提高,Fenton氧化法在飲用水處理中也得到了廣泛的應用,主要集中在對鹵代物的去除。Watter Z Tang等對Fenton法處理飲用水中的四種三鹵代烷的動力學情況進行了深入研究,結果發現:對不同濃度的溴仿,當pH=3.5時,過氧化氫和亞鐵離子的最佳摩爾比為1.9~3.7時溴仿在3min時的降解率可達85%,降解機理符合準一級動力學方程,但在此過程中氯仿並沒有發生降解。這說明Fenton試劑更易降解三溴甲烷。
此外,很多研究表明Fenton試劑可以有效的降解飲用水中的THMs,即使含量很少的情況,並且研究發現Fenton試劑還可以將THMs的前體物氧化成二氧化碳和水,從而解決了飲用水處理過程中的難點問題。