質粒抽提
質粒抽提
提取質粒DNA的方法有很多種,從提取產量上分可分為微量提取、中量提取、大量提取,從使用儀器上分可分為一般提取和試劑盒方法提取,從具體操作方法分可以分為鹼裂解法、煮沸法、牙籤法等,各種不同的方法各有其優缺點,根據不同的實驗目的可以採用合適的提取方法。詳細內容請參考《分子克隆實驗指南》。另外,復旦大學生化與分子生物學實驗室一篇文章,提供了質粒提取機理的詳細解說。
鹼裂解法
人們使用鹼與SDS裂解法從E. coli(大腸桿菌)中分離製備質粒DNA已有30多年的歷史。將細菌懸浮液暴露於高pH值的強陰離子洗滌劑中,會使細胞壁破裂,染色體DNA和蛋白質變性,將質粒DNA釋放到上清中。
儘管鹼性溶劑使鹼基配對完全破壞,閉環的質粒DNA雙鏈仍不會彼此分離,這因為它們在拓撲學上是相互纏繞的。只要OH-處理的強度和時間不要太過,當pH值恢復到中性時,DNA雙鏈就會再次形成。在裂解過程中,細菌蛋白質、破裂的細胞壁和變性的染色體DNA會相互纏繞成大型複合物,後者被十二烷基硫酸鹽包蓋。當用K+取代Na+時,複合物會從溶液中有效地沉澱下來,離心除去變性劑后,就可以從上清中回收復性的質粒DNA。
煮沸法
煮沸法是將細菌懸浮於含有Triton X-100和能消化細胞壁的溶菌酶的緩衝液中,然後加熱到100℃使其裂解。加熱除了破壞細菌外壁,還有助於解開DNA鏈的鹼基配對,並使蛋白質和染色體DNA變性。但是。閉環質粒DNA鏈彼此不會分離,這是因為它們的磷酸二酯骨架具有互相纏繞的拓撲結構。當溫度下降后,閉環DNA的鹼基又各就各位,形成超螺旋分子,離心除去變性的染色體DNA和蛋白質,就可從上清中回收質粒DNA。煮沸裂解法對於小於15kb的小質粒很有效,可用於提取步至lmL(小量製備),多至250mL(大量製備)菌液的質粒,並且對大多數的大腸桿菌菌株都適用。但對於那些經變性劑、溶菌酶及加熱處理后能釋放大量碳水化合物的大腸桿菌菌株,則不推薦使用該法。這是因為碳水化合物很難除去,會抑制限制酶和聚合酶活性。若碳水化合物的量很大,在CsCl-溴化乙錠梯度離心中會使超螺旋質粒DNA帶變得模糊不清。大腸桿菌菌株HBl01及其衍生菌株(其中包括TGl)能產生大量的碳水化合物,不適於用煮沸法裂解。
質粒小提試劑盒
用於大腸桿菌中質粒DNA的小量提取,它結合了優化的鹼裂解法,以及方便快捷的硅膜離心技術,具有高效,快捷的特點,能在30min內完成全部操作。利用試劑盒能從1-5mL過夜培養的大腸桿菌菌液中純化得到10-40μg高質量的質粒DNA(OD260/OD280=1.7-1.9),此質粒DNA可直接用於DNA序列分析,各種酶促反應,PCR以及部分細胞系的轉染等。
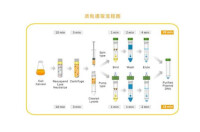
質粒抽提
其中用到三種溶液以及硅酸纖維膜(超濾柱)。溶液Ⅰ:50 mM葡萄糖 / 25 mMTris-HCl/ 10 mMEDTA,pH 8.0;溶液Ⅱ:0.2 N NaOH / 1%SDS;溶液Ⅲ:3 M 醋酸鉀/ 2 M 醋酸/75%酒精。
此步為鹼處理。其中NaOH主要是為了溶解細胞,釋放DNA,因為在強鹼性的情況下,細胞膜發生了從雙層膜結構向微囊結構的變化。SDS與NaOH聯用,其目的是為了增強NaOH的強鹼性,同時SDS作為陰離子表面活性劑破壞脂雙層膜。這一步要記住兩點:第一,時間不能過長,因為在這樣的鹼性條件下基因組DNA片斷也會慢慢斷裂;第二,必須溫柔混合,不然基因組DNA會斷裂。
溶液III的作用是沉澱蛋白和中和反應。其中醋酸鉀是為了使鉀離子置換SDS中的鈉離子而形成了PDS,因為十二烷基硫酸鈉(sodium dodecylsulfate)遇到鉀離子后變成了十二烷基硫酸鉀(potassium dodecylsulfate, PDS),而PDS是不溶水的,同時一個SDS分子平均結合兩個氨基酸,鉀鈉離子置換所產生的大量沉澱自然就將絕大部分蛋白質沉澱了。2 M的醋酸是為了中和NaOH。基因組DNA一旦發生斷裂,只要是50-100 kb大小的片斷,就沒有辦法再被 PDS共沉澱了,所以鹼處理的時間要短,而且不得激烈振蕩,不然最後得到的質粒上總會有大量的基因組DNA混入,瓊脂糖電泳可以觀察到一條濃濃的總DNA條帶。75%酒精主要是為了清洗鹽份和抑制Dnase;同時溶液III的強酸性也是為了使DNA更好地結合在硅酸纖維膜上
Ⅰ.使用質粒提取試劑盒提取質粒時請參考具體試劑盒的操作說明。如Omega公司的E.Z.N.A.® Plasmid Mini Kit I, Q(capless) Spin(質粒提取盒)。
Ⅱ.鹼裂解手提法:此方法適用於小量質粒DNA的提取,提取的質粒DNA可直接用於酶切、PCR擴增、銀染序列分析。方法如下:
1:接1%含質粒的大腸桿菌細胞於2mlLB培養基。
2:37℃振蕩培養過夜。
3:取1.5ml菌體於Ep管(離心管),以4000rpm離心3min,棄上清液。
4:加0.lml溶液I(1%葡萄糖,50mM/LEDTApH8.0,25mM/LTris-HClpH8.0)充分混合。
5:加入0.2ml溶液II(0.2mM/LNaOH,1%SDS),輕輕翻轉混勻,置於冰浴5min.
6:加入0.15m1預冷溶液III(5mol/LKAc,pH4.8),輕輕翻轉混勻,置於冰浴5min.
7:以10,000rpm離心20min,取上清液於另一新Ep管
8:加入等體積的異戊醇,混勻后靜置10min.
9:以10,000rpm離心20min,棄上清。
10:用70%乙醇0.5ml洗滌一次,抽干所有液體。
11:待沉澱乾燥后,溶於50ulTE緩衝液中(或60℃溫育去離子水)
1:加溶液II(裂解液)后,操作一定要溫和,劇烈混合會導致基因組DNA污染。
2:洗脫時60℃溫育(Ellution Buffer)洗脫緩衝液或去離子水效果更好。
3:若質粒提取含量低,可增加菌液樣或換用ArtMedia Plasmid Culture,其比LB培養基質粒得量高
4:菌體應徹底懸浮,如果沒有徹底懸浮菌體,則殘留的菌體團塊在溶液 II 加入后,變成難以完全裂解的團塊。這個團塊在溶液 III 加入后,會有一部分蛋白質繼續存在於溶液中,成為蛋白質殘留的最大根源。
5:加入溶液 II 后,混勻,體系最好能立即變得清澈。體系如果變得清澈了,馬上加入溶液 III 中和。
6:中和的操作,在 1.5ml 離心管中加入溶液 III 后,先顛倒兩次,使管底朝上,用指頭彈擊管底數次,再顛倒混勻。效果非常好。
降低RNA殘留的方法
RNA 的去除,首先是使用 RNase 消化。在溶液 I 中加入高濃度的 RNase A (100ug/ml),或者用含 25ug RNase A/ml TE 溶解抽提好的質粒,都可以降低 RNA 殘留,但都不能徹底去除。幸運的是,RNA 的殘留並不影響酶切等最常用的用途。如果想徹底去除 RNA 殘留,可以用試劑盒,或者使用對 4 個鹼基都作用的 RNase。
降低gDNA殘留的方法
gDNA 的殘留問題,必須在抽提過程中解決,否則,就只能用膠回收方法處理了。gDNA 越大,越難於復性,也就越容易被去除;所以,一定要儘可能不打斷 gDNA。裂解體系越粘稠,gDNA 越容易被扯斷;操作手法越重,gDNA 也越容易被打斷。溫和操作,使用相對過剩的試劑,是降低 gDNA 殘留的最好方法。
降低蛋白質殘留的方法
蛋白質的去除,主要是靠不溶解的 K-SDS-蛋白質複合物的形成。雖然將中和后的體系置於 4C 一段時間,可以形成更多的該不溶複合物,從而使蛋白質殘留更少,但實踐證明這樣做並不是必須的,除非是大量抽提。只要加入溶液 I 后的懸浮,加入溶液 II 后的裂解及加入溶液 III 后的中和是均勻徹底的,蛋白質的殘留就應該在可以滿足實驗要求的水平;而只有溶液的用量足夠,甚至過剩,才能確保裂解和中和是徹底的。當然,試劑盒及苯酚的使用,是可以更進一步降低蛋白質的殘留的。
降低質粒Nick的方法
細菌收穫時間,菌株的選擇,抽提操作的劇烈程度是影響 Nick 的三個主要因素。細菌收穫過早,質粒還在複製過程中,Nick 的比例較高;過晚,細菌開始死亡,雜質會比較多。如果使用胞內酶含量很高的宿主菌,會出現較高比例的 Nick。加入溶液 II 及加入溶液 III 的混勻操作,也可以導致一些 Nick,但影響不會比前兩者大。
降低變性超螺旋的方法
理論上,用鹼裂解法抽提質粒,變性超螺旋的出現是不可避免的。之所以大家沒有非常在意,一是因為它的存在似乎對酶反應沒有任何影響,二是因為它的含量並不一定高到被用電泳觀察到。抽提使用相對過剩的溶液,在加入溶液 II 后,體系能在 1 分鐘內變澄清,再快速加入溶液 III,這樣基本上能將變性超螺旋的出現控制在電泳看不見的水平。 (變性超螺旋電泳時比正常超螺旋跑得快一點點。)
關於質粒多聚體
QIAGEN 提供了一個沒有進一步解釋的觀察:從有些宿主菌中抽提質粒 (pTZ19),電泳能發現很多條帶;但使用單酶切后,仍然變成一條帶,大小正好是線性單質粒的大小。根據這一觀察,可以推理如下:那些大的條帶(質粒多聚體)是由完整的單質粒“粘”在一起形成的,而不是我的一條鏈與你的一條鏈復性在一起;第二,這種“粘”只是部分的,否則酶切會有問題;第三,這種“粘”是脆弱的,線性后的剛性足以打破它。如果是這樣,質粒多聚體的出現與質粒的結構及序列有關,可以不管它(也管不了),因為它不影響酶切,或者說,即使質粒多聚體切不動,也不會影響太大。總之,碰到這種情況,不要簡單地認為有問題,而是應該一步一步往下做,但一定要做完一步,檢測一次,看一看結果與預期的吻合程度。
提高得率的方法
利用氯黴素抑制染色體的複製,而不抑制質粒的複製這一特點,在低拷貝質粒(如pUC19)的培養過程中添加氯黴素可以大大提高得率。