Feulgen染色
Feulgen染色
DNA-Feulgen染色方法由Feulgen等人在1924年建立,這種方法至今仍然是DNA定量測定的主要染色方法之一。這種方法的反應機理可表示為下式:2HCl+Na2S2O5→2NaCl+SO2+H2SO3。本詞條對這種方法的誕生及機理進行了詳細介紹,並針對幾個注意事項:對照切片的製做、固定劑的選擇、水解時間和Schiff試劑的作用一一進行了說明。
自從1924年Feulgen等人建立了DNA-Feulgen染色方法以來,至今這種方法仍是DNA定量測定的主要染色方法之一.Feulgen染色是經典顯示脫氧核糖核酸的方法,該法要求用Carnay氏液固定的新鮮組織效果最好,酒精-甲醛液次之,單純甲醛固定欠佳,效果不滿意.
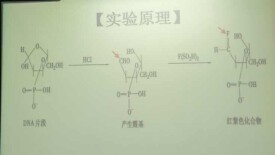
自Feulgen等發明該顯示DNA的Feulgen反應法以來,其作用機制也久經研究和討論,現已取得一致意見。其具體反應原理是,標本經稀鹽酸水解后,DNA分子中的嘌呤鹼基被解離,從而在核糖的一端出現了醛基。Schiff試劑中的無色品紅可與醛基反應,形成含有醌基的化合物分子, 因醌基為發色團,故可呈現出紫紅色。也就是說, DNA經稀酸水解后產生的醛基,具有還原作用,可與無色品紅結合形成紫紅色化合物,從而顯示出DNA的分佈。
2HCl+Na2S2O5→2NaCl+SO2+H2SO3
DNA是主要的遺傳物質,集中於染色體上。1924年孚爾根首先用席夫試劑(Schiff)作試驗,鑒定了染色體上DNA的存在,故稱為孚爾根染色法。孚爾根染色法的反應原理主要與席夫試劑的化學性質有關,此試劑的基本成分是鹼性品紅,偏亞硫酸氫鈉(NaHSO3)和鹽酸。鹼性品紅的主要成分是三氨基三苯甲烷氯化物。
利用1M HCl 、60℃下水解時,可將DNA分子中嘌呤鹼基與去氧核糖之間的糖苷鍵打斷,使嘌呤脫下,並使去氧核糖C-1位置釋放醛基與席夫試劑反應顯紫紅色。細胞中只有DNA才具有這種專一的孚爾根反應,因此利用孚爾根反應,可以鑒定DNA的存在。並廣泛應用於核及染色體的研究中。
進行Feulgen反應時, 一般要做一對照切片以便驗證反應結果。對照切片應不經水解直接放在schiff劑內,且應為負反應。但需要注意的是,對照切片在schiff試劑中最多不要超過1 h (0.5 h即可),時間過長,試劑本身的酸性也會使DNA水解,從而出現假的正反應。
以前很多人認為,選用的固定劑不應含有醛基或含有氧化劑。後來發現含醛基或氧化劑的固定劑對反應的專一性並沒有影響。實踐證明,一切好的組織學固定劑均適用於Feulgen反應。如Bhampy固定劑、Helly固定劑、Flemming固定劑、OsO4固定劑、Carnoy固定劑、zenker固定劑和Bouin-Aller固定劑。
但在上述固定劑中,以OsO4和Carnoy效果較好,OsO4(1%或0.5%)是Feulgen反應的理想固定劑,只是因OsO4價錢較貴,故一般多採用Carnoy固定液。在Feulgen反應中,不能單獨使用Bouin定液,因為它是Feulgen反應的最壞固定劑,但經Aller改進后的Bouin-Aller固定液效果卻較好。
Feulgen反應通常用稀酸進行水解,但水解的時間一定要適當。如水解時間不夠, 反應就會變弱;如水解時間過長或水解地過於劇烈,則脫氧核糖也易掉下來,反應也會減弱。適當的水解時間一般為8~12min。但是水解時間長短也要視標本的類型(如厚薄等)、固定劑的性質以及酸的濃度而定。
Feulgen反應成功與否的一個非常關鍵的因素,就是schiff試劑的質量。有一大類試劑均稱為鹼性品紅,它們實際上是由幾種產品分別組成的。因此只能選用註明“DNA染色反應用”的鹼性品紅才行。此外,Schiff試劑的配製方法也可影響DNA的染色反應。