滲透壓定律
1886年范特霍夫發現的規律
1886年范特霍夫(van’t Hoff)根據實驗數據得出一條規律:對稀溶液來說,滲透壓與溶液的濃度和溫度成正比,它的比例常數就是氣體狀態方程式中的常數R。這條規律稱為范特霍夫定律。
用方程式表示如下:πV=nRT
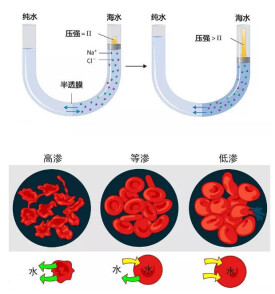
將溶液和水置於U型管中,在U型管中間安置一個半透膜,以隔開水和溶液,可以見到水通過半透膜往溶液一端跑,若於溶液端施加壓力,而此壓力可剛好阻止水的滲透,則稱此壓力為滲透壓,滲透壓的大小和溶液的重量摩爾濃度、溶液溫度和溶質解離度相關,因此有時若得之滲透壓的大小和其他條件,可以反推出大分子的分子量。范特霍夫因為滲透壓和化學動力學等方面的研究獲得第一屆諾貝爾化學獎。
或π=cRT
式中π為稀溶液的滲透壓,V為溶液的體積,c為溶液的濃度,R為氣體常數,n為溶質的物質的量,T為絕對溫度。
上式稱為范特霍夫公式,也叫滲透壓公式。常數R的數值與π和V的單位有關,當π的單位為kPa,V的單位為升(L)時,R值為8.31kPa·L·K-1·mol-1。
范特霍夫公式表示,在一定溫度下,溶液的滲透壓與單位體積溶液中所含溶質的粒子數(分子數或離子數)成正比,而與溶質的本性無關。
對於稀溶液,c近似於質量摩爾濃度,因此上式又可寫成:π=mBRT
對於相同cB的非電解質溶液,在一定溫度下,因為單位體積溶液中所含溶質的粒子(分子)數目相等,所以滲透壓是相同的。如0.3mol·L-1葡萄糖溶液與0.3mol·L-1蔗糖溶液的滲透壓相同。但是,相同cB的電解質溶液和非電解質溶液的滲透壓則不相同。例如,0.3mol.L-1NaCl溶液的滲透壓約為0.3mol.L-1葡萄糖溶液滲透壓的2倍。這是由於在NaCl溶液中,每個NaCl粒子可以離解成1個Na 和1個Cl-。而葡萄糖溶液是非電解質溶液,所以0.3mol·L-1NaCl溶液的滲透壓約為0.3 mol·L-1葡萄糖溶液的2倍。
由此可見,滲透壓公式中,對電解質溶液來說,濃度cB(或mB)是1升溶液中能產生滲透效應的溶質分子與離子總物質的量,稱為滲透物質的量濃度。
主要用於測定高分子(蛋白質等)的相對分子質量。