鈣調蛋白
鈣調蛋白
鈣調蛋白(calmodulin, CaM)又稱鈣調素,是一種普遍存在於各種真核細胞內,並能與鈣離子結合的多功能蛋白質。其濃度變化可調節細胞的功能,這種調節作用主要是通過鈣調蛋白而實現的。
鈣調蛋白參與細胞內多種信號轉導途徑,並在Ca依賴性信號轉導途徑中起到關鍵作用,是動態Ca感測器,能夠響應廣泛的Ca濃度,並向下游傳遞信號。
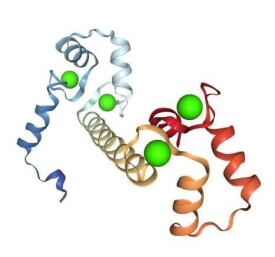
鈣調蛋白分子是由148個氨基酸殘基組成的高度保守的單鏈多肽,由N端和C端2個結構域及中間連接的螺旋結構組成。每個結構域均由兩個EF-hands模體組成,每個鈣調蛋白分子含有4個Ca結合位點。
鈣調蛋白/鈣調素calmodulin;CaM
鈣調蛋白是真核生物細胞中的胞質溶膠蛋白,由148個氨基酸組成單條多肽,相對分子質量為16.7kDa。
鈣調蛋白是一種分子量為16700的單鏈蛋白質,由148個氨基酸組成。等電點為4.3,是酸性蛋白質。不同生物來源的鈣調蛋白,其氨基酸組成和順序或完全一樣,或僅有少許差異。它耐酸,耐熱,十分穩定。鈣調蛋白和細胞內很多種酶的作用有關。在每個鈣調蛋白分子內,有4個可與鈣離子結合的區域,它們的一級結構極為相似。細胞內鈣離子水平通常維持在10-7摩爾濃度左右。當外來的刺激使細胞內鈣離子的濃度瞬息間升高至10-6~10-5摩爾濃度時,鈣調蛋白即與鈣離子結合,構象改變,螺旋度增加,成為活性分子,進而與酶結合,使之轉變成活性態。當鈣離子濃度低於10-6摩爾濃度時,鈣調素就不再與鈣離子結合,鈣調素和酶都復原為無活性態。因此,可以根據鈣離子濃度的變化來控制細胞內很多重要的生化反應。
至1982年,已得到電鰻和雞的鈣調素cDNA克隆和雞的鈣調蛋白基因克隆。根據前二者的核苷酸順序分析,得知它們的差異較大,但由之推測出的氨基酸順序仍基本相同。在雞的天然基因中,測得7個內含子,基因總長為12kb。在細胞分裂周期中和細胞癌變時,鈣調蛋白基因的表達加強。
鈣調蛋白的外形似啞鈴,有兩個球形的末端,中間被一個長而富有彈性的螺旋結構相連,長度為 6.5nm,每個末端有兩個Ca結構域,每個結構域可以結合一個Ca,這樣一個鈣調蛋白可以結合4個Ca ,每個位點都是由12個氨基酸殘基組成的套環,門冬氨酸和谷氨酸的側鏈提供Ca結合基團。其中C端的位點比N端位點的Ca 親和力強10倍。當C端位點與Ca 結合后,鈣調蛋白分子通過自身構象的改變,增加了N端位點的親和力,使結合型鈣調蛋白的含量與 Ca濃度呈拋物線關係,利於Ca發揮效應。
鈣調蛋白結構中含有7個α螺旋、4個Ca結合環區和兩個短的、反平行的雙鏈β摺疊。4個Ca結合區域是一個典型的螺旋-環-螺旋的 EF 手型結構,每個結構域均有類似的原子結構:2個α螺旋-Ca結合環-2個α螺旋。環兩側的2個α螺旋相互垂直,各約10個氨基酸;Ca結合環內含有門冬氨酸、谷氨酸和甘氨酸,是與Ca結合的部位。兩側的2個α螺旋因氫鍵及疏水作用,穩定Ca的配位結構。由於鈣調蛋白中不含易被氧化的半胱氨酸Cys和羥脯氨酸Pro-OH等能使肽鏈定型的成分,鈣調蛋白在結構上具有高度的靈活性。
鈣調蛋白是一種鈣結合蛋白,存在於幾乎所有的真核細胞中。它的作用是對任何微量的鈣都能敏感地捕獲。鈣調蛋白只有在與Ca2+結合后才有活性。因此,激素可以通過影響細胞內Ca2+濃度變化來調控鈣調蛋白的活性。活性Ca2+·CaM複合物可以通過與靶酶作用方式調控代謝過程。即Ca2+·CaM複合物與靶酶,如磷酸二酯酶、蛋白激酶等作用,使靶酶構象發生變化(Ca2+作用結果)而活化,從而對代謝過程起調控作用。
與鈣結合后,CaM發生構型上的變化,成為一些酶的激活物。再與酶結合時,又引起酶的構型變化,使由非活性態轉為活性態,CaM-Ca2+成了這些酶作用時必不可缺的成分。CaM參與的生化反應很多,涉及不少關鍵性的酶,如:控制信息傳遞中,第二信使cAMP合成與分解的腺苷酸環化酶和磷酸二酯酶;在糖原合成與分解中能提供和儲存能量的磷酸化酶激酶和糖原合酶激酶,與蛋白質磷酸化及脫磷酸化有關蛋白激酶和蛋白磷酸解酶,能調節細胞內鈣離子濃度,起著鈣泵作用的Ca2+-ATPase,還有與平滑肌收縮有關的肌球蛋白輕鏈激酶等。CaM是由148個氨基酸組成的單鏈蛋白質,有四個Ca2+結合區,缺乏種屬和組織特異性。不同來源,包括動物、植物以及低級真核生物所得到的CaM的氨基酸組成及排列基本相同。另外肽鏈中沒有Cys和Pro-OH,因此在結構上有極大的靈活性。
調控細胞增殖及細胞周期
真核生物的細胞增殖遠比原核生物複雜得多。在細胞增殖和細胞周期的過程中,鈣調蛋白具有重要的調節作用。鈣調蛋白在細胞中的分佈會隨著細胞周期的進行而遷移。在 G1 期,鈣調蛋白主要分佈在細胞質中,可與含肌動蛋白的微絲束組裝結合;當細胞分裂進入 S 期時,發現鈣調蛋白開始向細胞核中遷移;當分裂到 G2 期時,鈣調蛋白集中在細胞核中;在 M 期(分裂期),鈣調蛋白主要聚集在極粒和染色體之間的半紡錘體上。說明在不同時期,鈣調蛋白在細胞中存在的位置是不同的。
影響細胞增殖的一個重要指標就是鈣調蛋白的水平,而激活鈣調蛋白依賴性激酶所需要的鈣離子閾濃度隨鈣調蛋白濃度的變化而變化。鈣調蛋白的水平與 G1 期長短和進入 S 期細胞的百分數有直接的相關性,說明鈣調蛋白濃度水平對 G1 期向 S 期過渡起關鍵作用。在動植物中,鈣調蛋白所參與的周期調控有明顯的不同,說明細胞增殖在物種不同的進化水平上存在顯著的差異。鈣調蛋白除了可以調控胞內細胞增殖,在胞外也可以促進細胞增殖。
在細胞增殖的過程中,鈣調蛋白只是調控機制中的一個重要的環節。鈣調蛋白調控細胞增殖的特點歸納為:第一,啟動 DNA 合成,促進 G1/S 期的過度;第二,促進 G1/M 期的過度;第三,調控染色體的移動,並促進細胞進入有絲分裂後期。
參與調控靶酶活性
Ca-CaM複合體具有結合併調控下游靶酶的功能。現已確定的靶酶有磷酸化酶激酶、鳥苷酸環化酶、磷脂酶A2、肌球蛋白輕鏈激酶、磷酸二酯酶、鈣調蛋白激酶(CaMK)等。Ca-CaM複合體形成后,下游的靶酶活力會有不同程度的增加。在動物中,鈣調蛋白在腎上腺和腦中 cAMP的合成與降解的過程中扮演非常重要的角色;在植物中,鈣調蛋白可參與調節葉綠素光合作用的進行。在鈣調蛋白眾多靶酶中,在細胞中起到的作用、結合和活化的部位都有不同程度的差異,結合鈣調蛋白的靶酶不能證明靶酶被活化,但靶酶的活化是鈣調蛋白與靶酶結合的結果。
調節微管解聚