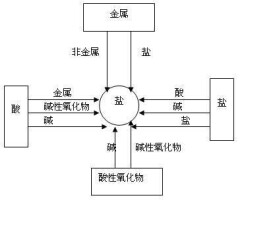
酸鹼鹽
化學概念
酸指電離時產生的陽離子全部都是氫離子的化合物;鹼指電離時產生的陰離子全部都是氫氧根離子的化合物;鹽指電離時生成金屬陽離子(或銨根離子)和酸根離子的化合物。可以簡記為:氫頭酸、氫氧根結尾鹼、金屬開頭酸根結尾的是鹽。
僅由氫離子和酸根離子、非金屬單質結合生成的化合物為酸。
由金屬離子和氫氧根離子結合生成的化合物為鹼。
由金屬離子和酸根離子結合生成的化合物為鹽,不一定都是如此。例子如Cu₂(OH)₂CO₃鹼式碳酸銅,有氫氧根
酸鹼鹽類化合物一定含有非金屬元素。
在化學上,廣義的鹽是由陽離子(正電荷離子)與陰離子(負電荷離子)所組成的中性(不帶電荷)的離子化合物
⒈和酸發生反應[複分解反應]酸+鹽→新鹽+新酸(強酸→弱酸)這裡的鹽可以是不溶性鹽。但不能是不溶於酸的鹽
[舉例]2HCl+Na2CO3=H2O+CO2↑+2NaCl (碳酸不穩定會繼續分解成水和二氧化碳)
⒉和鹼發生反應[複分解反應]鹼(可溶)+鹽(可溶)→新鹼+新鹽
[舉例]2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
⒊和某些金屬反應[置換反應]鹽+金屬單質(某些)→新金屬單質+新鹽
反應中的金屬一定要比鹽中的金屬活潑才可以把它給置換出來
[舉例]Zn+CuSO4=ZnSO4+Cu(有一個金屬活潑性順序表,活潑性依次減弱:鉀 鈣 鈉 鎂 鋁 鋅 鐵 錫 鉛 氫 銅 汞 銀 鉑 金。在這個實例中,鋅(Zn)的活潑性在銅(Cu)之前,所以可以把銅置換出來)。
正鹽:單由金屬離子(包括銨根離子)和酸根離子構成
酸式鹽:由金屬離子(包括銨根離子)、氫離子 酸根離子和非金屬離子構成
鹼式鹽:由金屬離子(包括銨根離子)、氫氧根離子 酸根離子和非金屬離子構成
復鹽:由不同金屬離子(包括銨根離子)和酸根離子構成
鹼式鹽詳細解釋:電離時生成的陰離子除酸根離子外還有氫氧根離子,陽離子為金屬離子(或銨根)的鹽。
酸跟鹼反應時,弱鹼中的氫氧根離子部分被中和,生成的鹽為鹼式鹽。鹼式鹽,二元鹼或多元鹼才有可能形成鹼式鹽。鹼式鹽的組成及性質複雜多樣。鹼式碳酸銅(也稱銅綠,銅生鏽后產生的物質)[Cu2(OH)2CO3]和鹼式氯化鎂[Mg(OH)Cl]等都屬於鹼式鹽。鹼式鹽是鹼被酸部分中和的產物。
鹽的種類
關於鹽呈酸性鹼性的口訣:"誰強顯誰性"
比如強酸弱鹼鹽顯酸性,強鹼弱酸鹽顯鹼性,
但如果是強酸強鹼鹽或弱酸弱鹼鹽就顯中性。
說明:強酸性的物質(或化合根)有: Cl (氯) (硝酸根) (硫酸根)等
弱酸性的物質(或化合根)有: (碳酸根)等
強鹼類的物質(或化合根)有:Na(鈉)、K(鉀)等
弱鹼類的物質(或化合根)有:NH4 (銨根)、Cu(銅)等
強酸強鹼鹽:中性(pH=7)(如:NaCl, KNO3)
強酸弱鹼鹽:酸性(pH<7)(如:NH4Cl,CuSO4)
弱酸強鹼鹽:鹼性(pH>7)(如:Na2CO3)
(1)酸+鹼=鹽+水 即:中和反應。
反應條件:無
反應類型:複分解反應
例:H2SO4(酸)+Mg(OH)2(鹼)=MgSO4(鹽)+2H2O(水)
(2)酸+鹽=新酸+新鹽
反應條件:有氣體或者弱電解質或者沉澱生成才能反應
反應類型:複分解反應
例:2HCI(酸)+Na2CO3(鹽)=H2CO3(新酸)+2NaCl(新鹽)
但是碳酸不穩定:H2CO3=H2O+CO2↑這樣就有氣體和水生成了
(3)酸+活潑金屬=鹽+氫氣
反應條件:金屬是活潑金屬
反應類型:置換反應
例:2HCl(鹽酸)+Fe(活潑金屬)=FeCl2(鹽)+H2↑(氫氣)
(4)酸+金屬氧化物=鹽+水
反應條件:無
反應類型:複分解反應
例:H2SO4(酸)+CuO(鹼性氧化物)=CuSO4(鹽)+H2O(水)
口訣:鉀鈉銨鹽硝酸鹽,全能溶於水中間
鹽酸鹽不溶銀亞汞,硫酸鹽不溶鋇和鉛
碳酸鹽類多不溶,易溶只有鉀鈉銨
鹼類能溶鉀鈉鈣鋇銨
諸酸多溶解,硅酸不在內
(1)酸+鹼=鹽+水 即:中和反應。
反應條件:無
反應類型:複分解反應
例:H2SO4(酸)+Mg(OH)2(鹼)=MgSO4(鹽)+2H2O(水)
(2)鹼+鹽=新鹼+新鹽
反應條件:鹼和鹽必須都溶於水,有沉澱生成(二者同時滿足)
反應類型:複分解反應 條件:反應有沉澱或有弱電解質或有氣體生成。(簡記:上“↑”、下“↓”、水“H2O)
例:Ca(OH)2(鹼)+K2CO3(鹽)=CaCO3↓(新鹽)+2KOH(新鹼)
(3)鹼+一些非金屬氧化物=鹽+水
反應條件:非金屬氧化物是酸性氧化物
反應類型:複分解
例:Ca(OH)2(鹼)+CO2(非金屬氧化物)=CaCO3↓(鹽)+H2O(水)
此反應用於鑒別CO2。
酸
有腐蝕性,溶液呈酸性,能與活潑金屬發生反應,鹼,某些鹽和金屬氧化物反應 與排在氫之前的活潑金屬反應生成鹽和氫氣,與指示劑反應,pH顯酸性的溶液不一定是酸,但是酸一定是酸性溶液(即顯酸性)。
鹼
有腐蝕性。溶液呈鹼性,能與酸,某些鹽,非金屬氧化物反應,某些鹼能與某些金屬氧化物反應,與指示劑反應 鹼性溶液不一定是鹼,但是鹼一定是鹼性溶液。(顯鹼性的溶液不一定都是鹼溶液,即所謂的鹼;但鹼,一定顯鹼性,即pH值大於7。)
鹽
有些鹽有微弱的腐蝕性,溶液的酸鹼度根據鹽的性質判定,能與某些酸,鹼,鹽反應
還能和其他某些化合物反應
(1)金屬單質+酸 --------鹽+氫氣(置換反應)
(2)金屬單質+鹽(溶液) -------另一種金屬+另一種鹽
(3)鹼性氧化物+酸 --------鹽+水
(4)酸性氧化物+鹼 --------鹽+水
1.苛性鈉(強鹼)暴露在空氣中變質:2NaOH+CO2=Na2CO3+H2O
2.苛性鈉吸收二氧化硫氣體:2NaOH+SO2 =Na2SO3+H2O
3.苛性鈉吸收三氧化硫氣體:2NaOH +SO3=Na2SO4+H2O
4.消石灰放在空氣中變質:Ca(OH)2+CO2=CaCO3 ↓+H2O
(5)酸+鹼--------鹽+水
1.鹽酸和燒鹼反應:HCl + NaOH=NaCl+H2O
2.硫酸與氫氧化鈉反應:2NaOH+H2SO4=Na2SO4+2H2O
3.酸和氫氧化銅反應:2HCl + Cu(OH)2=CuCl2+2H2O
(6)酸+鹽-------另一種酸+另一種鹽
1.大理石與稀鹽酸反應:CaCO3+2HCl=CaCl2+H2O+CO2↑
2.碳酸鈉與稀鹽酸反應: Na2CO3+2HCl=2NaCl+H2O+CO2↑
(7)鹼+鹽-------另一種鹼+另一種鹽
1.氫氧化鈉與硫酸銅:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2.氫氧化鈉與氯化鐵:3NaOH+FeCl3 =Fe(OH)3↓+3NaCl
3.氫氧化鈉與氯化鎂:2NaOH+MgCl2=Mg(OH)2↓+2NaCl