過渡金屬元素
過渡金屬元素
過渡金屬元素(transition metals)是指元素周期表中d區與ds區(d區元素包括周期系第ⅢB~ⅦB,ⅦI族的元素。不包括鑭系和錒系元素。ds區包括周期表第ⅠB~ⅡB族元素。)的一系列金屬元素,又稱過渡金屬。一般來說,這一區域包括3到12一共十個族的元素,但不包括f區(周期表中58~71號元素叫做4f內過渡元素,90~103號元素叫做5f內過渡元素,它們都屬於f區元素。)的內過渡元素。
“過渡元素”這一名詞首先由門捷列夫提出,用於指代8、9、10三族元素。他認為從鹼金屬到錳族是一個“周期”,銅族到鹵素又是一個,那麼夾在兩個周期之間的元素就一定有過渡的性質。這個詞雖然還在使用,但已失去了原意。
過渡金屬元素的一個周期稱為一個過渡系,第4、5、6周期的元素分別屬於第一、二、三過渡系。
| 族 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 第一過渡系 | 21,Sc-鈧 | 22,Ti-鈦 | 23,V-釩 | 24,Cr-鉻 | 25,Mn-錳 | 26,Fe-鐵 | 27,Co-鈷 | 28,Ni-鎳 | 29,Cu-銅 | 30,Zn-鋅 |
| 第二過渡系 | 39,Y-釔 | 40,Zr-鋯 | 41,Nb-鈮 | 42,Mo-鉬 | 43,Tc-鍀 | 44,Ru-釕 | 45,Rh-銠 | 46,Pd-鈀 | 47,Ag-銀 | 48,Cd-鎘 |
| 第三過渡系 | 71,Lu-鑥 | 72,Hf-鉿 | 73,Ta-鉭 | 74,W-鎢 | 75,Re-錸 | 76,Os-鋨 | 77,Ir-銥 | 78,Pt-鉑 | 79,Au-金 | 80,Hg-汞 |
| 第四過渡系 | 103,Lr-鐒 | 104,Rf-釒盧 | 105,Db- | 106,Sg- | 107,Bh- | 108,Hs- | 109,Mt-釒麥 | 110,Ds-釒達 | 111,Rg-釒侖 | 112,Cn-鎶 |
過渡金屬由於具有未充滿的價層d軌道,基於十八電子規則,性質與其他元素有明顯差別。
由於這一區很多元素的電子構型中都有不少單電子(錳這一族尤為突出,d5構型),較容易失去,所以這些金屬都有可變價態,有的(如鐵)還有多種穩定存在的金屬離子。過渡金屬最高可以顯+7(錳)、+8(鋨)氧化態,前者由於單電子的存在,後者由於能級太高,價電子結合的較為鬆散。高氧化態存在於金屬的酸根或醯基中(如:VO43-釩酸根,VO22+釩醯基)。
對於第一過渡系,高氧化態經常是強氧化劑,並且它們都能形成有還原性的二價金屬離子。對於二、三過渡系,由於原子半徑大、價電子能量高的原因,低氧化態很難形成,其高氧化態也沒有氧化性。同一族的二、三過渡系元素具有相仿的原子半徑和相同的性質,這是由於鑭系收縮造成的。
由於空的d軌道的存在,過渡金屬很容易形成配合物。金屬元素採用雜化軌道接受電子以達到16或18電子的穩定狀態。當配合物需要價層d軌道參與雜化時,d軌道上的電子就會發生重排,有些元素重排后可以使電子完全成對,這類物質稱為反磁性物質。相反,當價層d軌道不需要重排,或重排后還有單電子時,生成的配合物就是順磁性的。反磁性的物質沒有顏色,而順磁性的物質有顏色,其顏色因物質而異,甚至兩種異構體的顏色都是不同的。一些金屬離子的顏色也是有單電子的緣故。
大多數過渡金屬都是以氧化物或硫化物的形式存在於地殼中,只有金、銀等幾種單質可以穩定存在。
最典型的過渡金屬是4-10族。銅一族能形成配合物,但由於d10構型太穩定,最高價只能達到+3。靠近主族的稀土金屬只有很少可變價態。12族元素只有汞有可變價態,鋅基本上就是主族金屬。由於性質上的差異,有時銅、鋅兩族元素並不看作是過渡金屬,這時d區元素這一概念也就縮小至3到10族,銅鋅兩族合稱ds區元素。
Ⅷ族 Fe Co Ni 鐵系
Ru Rh Pd Os Ir Pt 鉑系
最高氧化值不等於族序數。
鐵約佔地殼質量的5.1%,居元素分佈序列中的第四位。鐵最高氧化態+6,常見氧化態+2和+3。鈷和鎳最高氧化態為+4,氧化態有+3和+2。
酸性溶液中,Fe、Co、Ni離子穩定,空氣中Fe被氧化為Fe;鹼性介質,鐵最穩定氧化態+3,而鈷和鎳的最穩定氧化態+2;在干態,Fe直接氯化卻得FeCl3,因為Fe的第三電離勢較小。Co和Ni同氯氣反應不能生成三氯化物。
Fe2+ + 2OH- Fe(OH)2 ↓;
4 Fe(OH)2 + O2 + 2H2O 4 Fe(OH)3 ↓
單質鐵、鈷、鎳銀白色金屬。有鐵磁性。鐵是最重要結構材料。鈷和鎳主要用於製造合金。如鈷、鉻、鎢的合金具有很高的硬度和防鏽性能。鎳粉可做加氫反應的催化劑,鎳制坩堝在實驗室里常用。
(1)氧化數為+2的鐵的化合物
氫氧化亞鐵:主要呈鹼性,酸性很弱,但能溶於濃鹼。
硫酸亞鐵:製取: 2FeS2 + 7O2 + 2H2O 2FeSO4 + 2H2SO4
溶液中析出的是淺綠色的七水合硫酸亞鐵FeSO4·7H2O,俗稱綠礬。
硫酸亞鐵易溶於水,在水中有微弱的水解,使溶液顯酸性;硫酸亞鐵被空氣氧化,
2FeSO4 + 1/2O2 + H2O 2Fe(OH)SO4
硫酸亞鐵與鹼金屬硫酸鹽形成復鹽M2ISO4·FeSO4·6H2O。最重要的復鹽是FeSO4·(NH4)2SO4·6H2O(摩爾氏鹽),常被用作還原試劑。
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
6FeSO4 + K2Cr2O7 + 7H2SO4 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 7H2O
配合物:黃血鹽K4[Fe(CN)6] ·3H2O,赤血鹽K3[Fe(CN)6],普魯士藍、滕氏藍 KFe[Fe(CN)6]。滕氏藍和普魯士藍的組成與結構一樣,如圖21-3。
K+ + Fe3+ + [Fe(CN)6]4- KFe[Fe(CN)6]↓普魯士藍
K+ + Fe2+ + [Fe(CN)6]3 KFe[Fe(CN)6] ↓滕氏藍
2K4[Fe(CN)6] + Cl2 2KCl + 2K3[Fe(CN)6]
4K3[Fe(CN)6] + 4KOH 4K4[Fe(CN)6] + O2 + 2H2O
Fe3+ + SCN- [Fe(SCN)] 2+ (血紅色)
二茂鐵(C5H5)2Fe是一種夾心式結構的配位化合物。Fe和C5H5之間是由C5H5環的π軌道與Fe的空d軌道重疊形成。
2C5H5MgBr + FeCl2 (C5H5)2Fe + MgBr2 + MgCl2
(2)氧化數為+3的鐵的化合物
三氧化二鐵:具有α和γ兩種構型。α型順磁性,γ型鐵磁性。自然的赤鐵礦是α型。FeO和Fe2O3的混合氧化物Fe3O4(磁性氧化鐵),具有磁性,是電的良導體,是磁鐵礦的主要成分。
三氯化鐵:具有明顯共價性,易潮解,溶解在有機溶劑(如丙酮)中,以雙聚分子Fe2Cl6存在, Fe在酸性溶液中是較強氧化劑。
2FeCl3 + 2KI 2KCl + 2FeCl2 + I2;
2FeCl3 + H2S 2FeCl2 + 2HCl + S
2FeCl3 + SnCl2 2FeCl2 + SnCl4
Fe離子在溶液中明顯地水解,水解過程很複雜。首先,發生逐級水解,其次,隨著水解的進行,同時發生各種類型的縮合反應,p1023。
(3)氧化數為+6的鐵的化合物
在酸性介質中高鐵酸根離子FeO4是一個強氧化劑,在強鹼性介質中,Fe(III) 能被一些氧化劑如NaClO所氧化:
2Fe(OH)3 + 3ClO- + 4OH- 2FeO42- + 3Cl- + 5H2O
粉紅色Co(OH)2被空氣氧化為棕褐色Co(OH)3,而綠色Ni(OH)2不被空氣氧化。Co(OH)2兩性顯著,Ni(OH)2鹼性。
CoCl2·6H2O粉紅 CoCl2·2H2O紫紅
CoCl2·H2O藍紫 CoCl2藍
易形成配合物,影響氧還性。Co最穩定,Co氧化性很強。但:
2[Co(NH3)6]2+ + 1/2O2 + H2O 2[Co(NH3)6]3+ + 2OH-
2K4[Co(CN)6] + 2H2O 2K3[Co(CN)6] + 2KOH + H2↑
鈷(III)能與NO2,NO3,OH,NH2,NH,O2,O2等形成多種形式的配合物和同分異構現象。
Ni (II) 也可形成多種配合物,與丁二酮肟生成二丁二酮肟合鎳(II)螯合物(鮮紅色),是檢驗Ni的特徵反應。
羰基配合物
鐵、鈷、鎳在某些配合物中呈現低氧化態+1,0,-1,-2。羰基配合物是典型。如Ni(CO)4 ,Fe(CO)5,HCo(CO)4。
結構:σ配鍵和反饋鍵(圖21-7)。
穩定性:由於σ配鍵和反饋鍵兩種成鍵作用同時進行,使金屬與一氧化碳形成的羰基化合物具有很高穩定性。
製備:多數羰基配位物可以通過金屬和一氧化碳的直接化合製備,但金屬必須是新還原出來的具有活性的粉狀物。
Ni + 4CO Ni(CO)4; Fe + 5CO Fe(CO)5
性質:熔點、沸點比常見金屬化合物低,易揮發,受熱易分解為金屬和一氧化碳。可利用這些特性來分離或提純金屬。羰基化合物有毒。
釕、銠、鈀的密度12g·cm,輕鉑金屬;鋨、銥、鉑的密度約為22 g·cm,重鉑金屬。釕和鋨,銠和銥不溶於強酸和王水。鈀和鉑能溶於王水,鈀溶於硝酸和熱硫酸。
鉑系金屬在有氧化劑存在時與鹼熔融,變成可溶性物。鉑系金屬催化活性很高。能吸收氣體,特別是氫氣。鉑在自然界往往以金屬單質的形式存在於礦物中。鉑具有很好的延展性和可鍛性,它的延展性接近於銀和金。緻密的鉑在空氣中加熱不會失去原有光澤。
PtCl2·C2H4是第一個不飽和烴與金屬的配合物。 [Pt(C2H4)Cl2]2中性化合物是一個具有橋式結構的二聚物,兩個乙烯分子以反式排布。配離子[Pt(C2H4)Cl3]的構型是平面四邊形(圖21-8,圖21-9)。
二氯化鈀:把金屬鈀直接氯化得二氯化鈀PdCl2,823K以上得不穩定的α-PdCl2,823K以下轉變為β-PdCl2。α-PdCl2的結構呈扁平的鏈狀(圖21-11),β- PdCl2的分子結構以Pd6Cl12為單元(圖21-12)。
二氯化鈀用作乙烯氧化成乙醛的催化劑,是重要的配位催化反應。二氯化鈀水溶液遇一氧化碳即被還原成金屬鈀(黑色) :
PdCl2 + CO + H2O Pd↓+ CO2 + 2HCl
六方緊堆、面心立方緊堆、體心立方晶格,金屬光澤,強度高、延展性好、加工性能好、導熱電性高、密度、硬度大、熔沸點高(表21-6 )。
金屬的密度自左向右增大,到銅族前後,出現密度減小現象。從上到下,原子半徑增大,第3過渡系金屬密度特別大,重鉑金屬的密度最大。
除s電子外,次外層d電子也可作價電子參加金屬鍵形成,形成較強金屬鍵。在各過渡系列,鉻族金屬的熔點最高,硬度也很大。
熔點、沸點高 熔點最高的單質:鎢(W)
硬度大 硬度最大的金屬:鉻(Cr)
密度大 密度最大的單質:鋨(Os)
原子半徑
由於過渡金屬的d軌道未飽和,對核電荷的屏蔽能力較差,各周期自左向右有效核電荷依次增大,半徑依次減小。由於d結構有較大屏蔽作用,到銅族元素前後出現原子半徑增大現象。
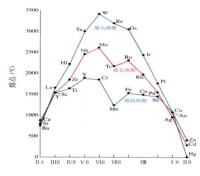
熔點變化
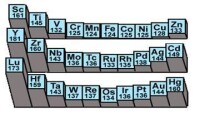
過渡金屬元素
過渡金屬的電離勢隨離子電荷增加沒有發生突變而只是逐漸增大,且(n-1)d與ns電子能量很接近,都能起價電子作用,表現多種氧化態。
第三過渡系金屬第一電離勢比其他兩個過渡系金屬高(圖21-14)。鑭系收縮,第二、三過渡系同族元素原子半徑很接近。4f電子屏蔽作用較弱,6s電子的鑽穿效應增強,表現“惰性電子對效應”,6s電子較難電離。

過渡金屬元素
同副族 沒規律
1. 過渡金屬的氧化態及其穩定性
氧化態由+2到與族數相同的最高氧化態。同周期從左向右,氧化態先是逐漸升高,但第4周期在錳以後,第5周期在釕以後,第6周期在餓以後,氧化態又逐漸降低,最後與IB銅族元素的低氧化態相同。
影響氧化態穩定性的因素包括生成焓ΔfH˚、電離勢和配位體等。
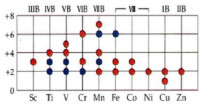
過渡金屬元素
第一過渡系元素比第二過渡系顯示較強金屬活潑性,容易出現低氧化態,ψ˚M+/M均為負值。隨著原子序數的遞增,第一過渡系金屬活潑性逐漸減弱。各元素最穩定氧化態是+2,或+3。
第二、三過渡系元素的氧化態-吉布斯自由能圖相似,與第一過渡系元素有差別,歸因於鑭系收縮。第二、三過渡系元素的金屬活潑性較差,不易被氧化,ψ˚M+/M一般為正值。隨原子序數遞增,金屬活潑性遞減。
同一過渡系列元素最高氧化態含氧酸ψ˚隨原子序數遞增而增大,即氧化性隨原子序數遞增而增強。這與同周期主族元素的情況相似。
同族過渡元素最高氧化態含氧酸ψ˚隨周期數增加而略有下降。它們的氧化性隨周期數的增加逐漸減弱,趨向於穩定。
物質磁性起源於物質內部電子和核子的運動。成單d電子的自旋運動使其具有順磁性。不具有成單電子的物質反磁性。
電子磁性,主要是由成單電子自旋運動和繞核的軌道運動所產生。第一過渡金屬配合物,磁矩主要由電子自旋貢獻。
n=1,μs = 1.73B.M.;n=2,μs = 2.83B.M.;
n=3,μs = 3.87B.M.;n=4,μs = 4.90B.M.
過渡金屬的顏色產生於d-d躍遷和電荷躍遷。d的過渡金屬化合物主要發生d-d躍遷,d電子組態的過渡金屬化合物主要發生電荷躍遷。
Mn (Ⅱ) Fe(Ⅱ) Co(Ⅱ) Ni(Ⅱ) Cu(Ⅱ) Zn(Ⅱ)

過渡金屬元素
離子半徑:在配合物中,由於配體場效應影響,離子半徑隨d電子數變化不規則,實際得到的是一條很不規則的曲線(圖21-19中的實線)。
水合熱:同一過渡系的金屬離子水合熱,出現“兩巔峰”實驗曲線(八面體) (圖21-20中的實線)。可用晶體場理論解釋。
過渡金屬之間有形成同核或異核金屬-金屬鍵的顯著傾向。如Mn2(CO)10(圖21-21)。金屬-金屬鍵有可能是重鍵。
