共找到3條詞條名為原位雜交的結果 展開
- 原位雜交
- 組織原位雜交
- 原位雜交組織化學技術
原位雜交
原位雜交
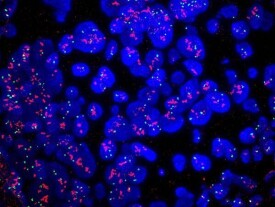
原位雜交是指將特定標記的已知順序核酸為探針與細胞或組織切片中核酸進行雜交,從而對特定核酸順序進行精確定量定位的過程。原位雜交可以在細胞標本或組織標本上進行。有熒光原位雜交。
RNA原位核酸雜交又稱RNA原位雜交組織化學或RNA原位雜交。該技術是指運用cRNA或寡核苷酸等探針檢測細胞和組織內RNA表達的一種原位雜交技術。其基本原理是:在細胞或組織結構保持不變的條件下,用標記的已知的RNA核苷酸片段,按核酸雜交中鹼基配對原則,與待測細胞或組織中相應的基因片段相結合(雜交),所形成的雜交體 (Hybrids)經顯色反應后在光學顯微鏡或電子顯微鏡下觀察其細胞內相應的mRNA、rRNA和tRNA分子。RNA原位雜交技術 經不斷改進,其應用的領域已遠超出DNA原位雜交技術。尤其在基因分析和診斷方面能作定性、定位和定量分析,已 成為最有效的分子病理學技術,同時在分析低丰度和罕見的mRNA表達方面已展示了分子生物學的一重要方向。

原位雜交
原位雜交技術的基本原理是利用核酸分子單鏈之間有互補的鹼基序列,將有放射性或非放射性的外源核酸(即探針)與組織、細胞或染色體上待測DNA或RNA互補配對,結合成專一的核酸雜交分子,經一定的檢測手段將待測核酸在組織、細胞或染色體上的位置顯示出來。為顯示特定的核酸序列必須具備3個重要條件:組織、細胞或染色體的固定、具有能與特定片段互補的核苷酸序列(即探針)、有與探針結合的標記物(曾呈奎等2000)。
組織診斷在許多生命中扮演著至關重要的作用,專註於質量、速度和效率將會產生很大的變化。原位雜交離不開染色,高級染色的各個方面,以及量身定製解決方案所需的選件,都整合到 IHC 和 ISH 染色之中。
1質粒的轉化和擴增
1.1製備XL1-Blue感受態細菌
1.取400uLXL1-Blue菌種加入到含200mlLB培養基的錐形瓶中,37℃、100rpm培養4h,離心,倒置,以冰冷的0.1mol/LCaCl_2重懸細菌,冰浴30min,離心,棄上清,倒置,再加4ml(含15%甘油)冰冷的CaCl2重懸細菌,分裝(200μ/tube),-80℃保存。
2.轉化:在冰浴中將1管XL1-Blue感受態菌解凍,將濃度為2ng/μ1的質粒DNA4μ1加入到8Oμ1感受態菌中。
3.輕輕搖勻,冰浴30min。
4.42℃熱激9O秒,然後迅速冰浴2min。
5.加入LB培養液(無氨苄青霉素)0.8ml,在37℃,100轉/min水浴孵育60min。
6.取200μl菌液鋪於瓊脂板上(塗有X-Gal(20mg/ml)-IPTG(200mg/ml)的LB-氨苄青霉素50mg/ml,1μl/ml培養基),待菌液全部被吸收后,倒置平板於37℃培養12-16h。
1.2鑒定和挑選含重組質粒的菌落
1.用無菌牙籤挑取單菌落,接種到10ml含氨苄青霉素的LB培養液的離心管中,於37℃,200轉/分培養2h,取1ml之一EPPENDORF離心管,加50μl10mmol/LEDTA(pH8.0)。
2.加入50μl新配置的0.2mol/LNaOH、0.5%SDS、20%蔗糖溶液后,振蕩30秒。
3.在70℃溫育5min,然後冷卻到室溫。
4.加1.5μ14mol/LKCl和0.5μ1含0.4%溴酚蘭染液,振蕩3O秒后,冰浴5min。
5.12000g,4℃離以3min,以除去細菌碎片。
7.當溴酚蘭遷移到凝膠全長的2/3-3/4時,停止電泳,在紫外燈下檢查質粒DNA分於量的大小是否與轉入質粒相符。
1.3質粒的擴增和純化
1.用無菌牙籤分別挑取單個白色菌落移入含30mlLB-氨苄青霉素(50μg/ml)培養液的聚丙烯管中,於37℃,200轉/分培養3h。
2.將菌液轉入含70mlLB-氨苄青霉素培養液的250ml錐形瓶中,37℃,200轉/分培養過夜(12-16h),細菌渾濁。
3.菌液中加入氯黴素液(34mg溶於lml乙醇,100ml菌液加入0.5ml氯黴素溶液,終濃度為170μ/ml)。37℃,200轉/分培養12-16h。
4.將培養的細菌倒入50ml的離心管中,6000rpm,4℃離,th,15min,沉澱細菌。
5.棄凈上清夜,用2ml預冷的溶液I,懸浮菌體沉澱,劇烈振蕩,於室溫靜置5min
6.加入新配製的溶液II4ml,快速用手晃動10秒,顛倒數次后,於室溫靜置10min。
7.加入預冷的溶液III3ml,溫和振蕩l0秒,於冰上靜置10min,出現白色絮狀沉澱。
8.6000rpm,4℃離心15min,保留上清。
9.將上清(若帶細菌殘片,則再次離心)移入另一50ml的離心管中,加入0.6倍體積的異丙醇混勻,於室溫靜置10min。(或-20℃4h,或4℃過夜,可便核酸沉澱)
10.12000rpm,4℃離心15min,回收核酸。小心棄去上清,倒置離心管使殘兼上清液流盡。
11.於室溫用70%的乙醇洗滌沉澱物和管壁,室溫12000rpm離心,15min,充分棄去乙醇,於室溫將離心管倒置在紙巾上,使最後殘餘的痕量乙醇揮發殆盡。
12.用500μlTE(pH8.0)溶解核酸沉澱,轉移至1.5mlEppendorf管中。
13.加入用冰預冷的5mol/L的LiCl溶液600μl,充分混勻。12000rpm,4℃離心15min,以沉澱高分子量的RNA。
14.將上清轉移到另一1.5mlEppendorf管中,加等量異丙醇,充分混勻,於室溫靜置10min。
15.12000rpm,4℃離心15min,回收核酸。小心棄去上清,倒置離心管使殘餘上清液流盡。
16.於室溫用70%的乙醇洗滌沉澱物和管壁,室溫12000rpm離心,15min,充分棄去乙醇,於室溫將離心管倒置在紙巾上,使最後殘餘的痕量乙醇揮發殆盡。
17.400μl含無DNA酶的RNA酶(20μg/ml)的TE緩衝液(pH8.0)溶解沉澱,將溶液轉移到另-1.5mlEppendorf管中,室溫放置1.5mlEppendorf管中30min。
18.加入400μl13%(v/v)的PEG8000-NaCl(1.6mol/L),混勻,4℃12000rpm離心5min以回收質粒DNA,棄去上清。
19.加入400μlTE緩衝液(pH8.O)溶解沉澱,再分別用等體積的Tris飽和酚、酚:氯仿:異戊醇(25:24:1)、和氯仿各抽提一次。
20.將水相(上清)移入另一1.5mlEppendorf管中,加入O.1體積(約50μ13M的醋酸鈉(pH5.2)和2倍體積(大約1ml)的無水乙醇,充分混勻後於4℃放置30min。
21.於4℃12000rpm離心5min回收沉澱的質粒DNA。儘可能棄去上清,敞開管口,置工作台上使殘留的痕量乙醇蒸發殆盡。
22.加入400μl處於4℃的70%乙醇,稍加振蕩,漂洗沉澱,4℃12000rpm離心2min。
23.吸去上清,室溫敞開管口,直到乙醇完全揮發。
24.用100μlTE緩衝液(pH8.0)溶解沉澱。
25.取4μl溶液1:100稀釋后,測定其OD260、OD280,以確定質粒DNA的純度和濃度(OD260/OD280>1.8。OD260/OD280對DNA而言其值大約為
1.8,高於2.0則可能有RNA污染,低於1.8則有蛋白質污染。;DNA濃度=OD260X0.05X稀釋倍數(μg/μl)。
26.質粒DNA溶液於-20℃保存待用。
1.將質粒DNA,用相應的限制性內切酶線性化,通過瓊脂糖凝膠電泳以確保完全線性化。
2.線性化后的DNA按“質粒的純化”步驟19-24進行純化,作為cRNA探針標記的模板,用相應的RNA聚合酶合成地高辛標記的反義和正義RNA探針。
3.進行體外轉錄,步驟如下:
4.在冰上將各試劑加入一1.5ml無RNA酶的Eppendorf管中。DEPC處理的三蒸水8μl
質粒DNA模板0.05μg/μl 1μl
10xNTP地高辛標記混合物 1x 2μl
0.1MDTT溶液 10mM 2μl
5x轉錄緩衝液1x 4μl
RNAse抑製劑 2U/μl1μl
RNA聚合酶 2U/μl 2μl
反應體系總體積 20μl
5.加入上述各試劑后,混勻,簡短離心后在37℃孵育2h。
6.加入2μl無RNA酶的DNA酶I(10U/μ1),37℃孵育15min降解模板DNA。
7.加入0.2MEDTA(pH8.0)溶液2μl終止反應。
8.加入2.5μl的4MLicl和7.5μl冷的無水乙醇,混勻,-20℃放置2h。
9.12000g下離以15min,棄上清,小心地用50μl冷的70%乙醇洗滌沉澱。
10.室溫下稍乾燥,溶於100μ1DEPC處理過的三蒸水中,混勻分裝,-20℃下保持備用。
3.1冰凍切片與雜交前預處理
1.將子宮樣品從-80℃取出,用OCT包埋,在-23℃(切片機腔體溫度)平衡至少30min。將包埋好的樣品固定在樣品頭上,切10μm厚的連續組織切片,平鋪於塗有多聚賴氨酸(1mg/m1)的玻片上(玻片預先經180℃干烤6小時),保存於-70℃冰櫃備用。
3.活躍的DEPC-PBS(未高壓的0.1%DEPC-1XPBS溶液)洗2次,每次5min。
4.在0.2M的鹽酸作用中作用10min后,重複步驟4)。
5.在切片上滴加蛋白酶K(0.1μg/m1),37℃孵育15min,重複步驟4)。
6.經0.1MTEA(三乙醇胺)作用5min后,再在新配製的0.25%AA/0.1MTEA(乙酸酐/三乙醇胺,pH8.0)中乙醯化10min。(在大多數實驗中,步驟4,5,6省略)
7.5xSSC中平衡15min。
3.2雜交
8.在脫水后的玻片上滴加預雜交液(約100μl/玻片),置於放有濕盒液(50%甲醯胺v/v;0.3MNaCl;1MmEDTA;10mMTris-Cl,pH8.O)的濕盒中,55~58℃下的烘箱中預雜交2h。
9.甩掉預雜交液,地高辛標記的反義或正義cRNA探針(濃度1-2ng/μl)經70℃變性1O分鐘,置冰上1min,玻片上滴加預雜交液(約60μl/玻片),覆蓋parafilm膜,放濕盒中在48~58℃下雜交18-30h。
3.3雜交后處理
10.取出玻片,小心去掉Parafilm膜,甩掉雜交液,用52℃預熱的5×SSC洗30min。
11.在無DNA的RNA酶A(20μg/ml)溶液中37℃下孵育30min。
12.分別依次用52℃預熱的2XSSC,1XSSC和O.1XSSC洗2次,每次30min。
3.4雜交信號檢測
13.在緩衝液A(0.1MTris-HC1pH7.5,0.15MNaC1)中平衡5min。
14.在玻片上滴加鹼性磷酸酶的抗地高辛抗體(1:500~1:2000稀釋於含0.5%阻斷液的緩衝液A中),室溫反應2h。
15.用緩衝液A洗2次,每次15min。
16.在緩衝液B(0.1MTris-HCl;0.1MNaCl;0.05MMgCl_2,pH9.5)中平衡5min。
17.硝基四氮唑藍(NBT)和5-溴-4-氯-3-吲哚氧磷酸鹽(BCIP)溶於緩衝液B中,每ml緩衝液B含有4.5μ1NBT和3.5μ1BCIP。在玻片上滴加混合染液在濕盒中顯色過夜。
18.充分顯色后,用EDTA(1mMEDTA,pH8.0)洗15min終止反應。
19.在95%乙醇中洗lh以除去非特異的背景。
20.用蒸餾水洗15min除去可能存在的結晶體。
21.脫水、透明,用中性樹膠封片。
22.充分乾燥后在顯微鏡下觀察、照相。
原位雜交組織化學技術(In Situ Hybridization Histochemistry, ISHH)在固定劑的應用和選擇上應兼顧到三個方面:保持細胞結構,最大限度地保持細胞內DNA或RNA的水平;使探針易於進入細胞或組織。DNA是比較穩定的,mRNA是相對穩定的但易為酶合成和降解。RNA卻絕然不同,非常容易被降解。因此,對於DNA的定位來說,固定劑的種類和濃度並不十分重要。相反,在RNA的定位上,如果要使RNA的降解減少到最低限度,那麼,不僅固定劑的種類濃度和固定的時間十分重要,而且取材后應儘快予以冷凍或固定。在解釋ISHH的結果時應考慮到取材至進入固定劑或冰凍這段時間對RNA保存所帶來的影響,因組織中mRNA的降解是很快的。在固定劑中,最常用的是多聚甲醛。和其它的固定劑(如戊二醛)不同,多聚甲醛不會與蛋白質產生廣泛的交叉連接,因而不會影響探針穿透入細胞或組織。
其它如醋酸-酒精的混合液和Bouin’s固定劑也能獲得較滿意的效果。對於mRNA的定位,我們常採用的方法是將組織固定於4%多聚甲醛磷酸緩衝液中1~2h,在冷凍前浸入15%蔗糖溶液中,置4℃冰箱過夜,次日切片或保存在液氮中待恆冷箱切片機或振蕩切片機切片。組織也可在取材后直接置入液氮冷凍,切片后才將其浸入4%多聚甲醛約10min,空氣乾燥后保存在-70℃。如冰箱溫度恆定,在-70℃可保存數月之久不會影響雜交結果。在病理學活檢取材多用福爾馬林固定和石蠟包埋,這種標本對檢測DNA和mRNA有時也可獲得雜交信號,但石蠟包埋切片由於與蛋白質交叉連接的增加,影響核酸探針的穿透,因而雜交信號常低於冰凍切片。同時,在包埋的過程中可減低mRNA的含量。
其它固定劑如應用多聚甲醛蒸汽固定乾燥后的冷凍切片也可獲得滿意效果。各種固定劑均有各自優缺點,如沉澱性(Precipitating)固定劑:酒精/醋酸混合液、Bouin’s液、Carnoy’s液等能為增加核酸探針的穿透性提供最佳條件,但它們不能最大限度地保存RNA,而且對組織結構有損傷。戊二醛能較好地保存RNA和組織形態結構,但由於和蛋白質產生廣泛的交叉連接,從而大大地影響了核酸探針的穿透性。至今,多聚甲醛仍被公認為ISHH較為理想的固定劑。
1.玻片的處理。玻片包括蓋片和載片應用熱肥皂刷洗,自來水清洗乾淨后,置於清潔液中浸泡24h,清水洗凈烘乾,95%酒精中浸泡24h后蒸餾水沖洗、烘乾,烘箱溫度最好在150℃或以上過夜以去除任何RNA酶。蓋玻片在有條件時最好用硅化處理,錫箔紙包裹無塵存放。由於ISHH的實驗周期長,實驗程序繁雜,因此,要應用粘附劑預先塗抹在玻片上,乾燥后待切片時應用,以保證在整個實驗過程中切片不致脫落。常用的粘附劑有鉻礬-明膠液,其優點是價廉易得,但在長周期實驗過程中,粘附效果不夠理想。多聚賴氨酸液具有較好的粘附效果,但價格昂貴,需進口。
2.增強組織的通透性和核酸探針的穿透性。此步驟根據應用固定劑的種類、組織的種類、切片的厚度和核酸探針的長度而定。比如用戊二醛固定的組織由於其與蛋白質產生廣泛的交叉連接就需要應用較強的增強組織通透性的試劑。增強組織通透性常用的方法如應用稀釋的酸洗滌、去垢劑(detergent)或稱清洗劑Triton X-100、酒精或某些消化酶如胃蛋白酶、胰蛋白酶、膠原蛋白酶和澱粉酶(diastase)等。這種廣泛的去蛋白作用無疑可增強組織的通透性和核酸探針的穿透性,提高雜交信號,但同時也會減低RNA的保存最和影響組織結構的形態,因此,在用量及孵育時間上應慎為掌握。
蛋白酶K(Proteinase K)的消化作用在ISHH中是應用於蛋白消化的關鍵步驟,其濃度及孵育時間視組織種類、應用固定劑種類、切片的厚薄而定。一般應用酶K1μg/ml(於0.1mol/L Tris/50mmol/L EDTA, pH8.0緩衝液中),37℃孵育15~20min,以達到充分的蛋白消化作用而不致影響組織的形態為目的。蛋白酶K還具有消化包圍著靶DNA的蛋白質的作用,從而提高雜交信號。在蛋白酶K消化后,應用0.1mol/L的甘氨酸溶液(在PBS中)清洗以終止蛋白酶K的消化作用,甘氨酸是蛋白酶K的抑製劑。為保持組織結構,通常用4%多聚甲醛再固定。Burns等(1987)報告應用胃蛋白酶(pepsin)20~100μg/ml(用0.1N HCl 配)37℃、30min進行消化,所獲實驗結果優於蛋白酶K。
不少實驗工作者在多聚甲醛固定后,浸入乙酸酐(acetic anhydride)和三乙醇胺(tri-ethanolamine)中以減低靜電效應,減少探針對組織的非特異性背景染色。有的作者除在室溫下浸於上述溶液10min外,還在預熱37℃的50%甲醯胺/2×SSC液中預雜交15min,然後用2×SSC,0.30mol/L NaAc/0.030mol/L枸櫞酸鈉液中浸15min。但Heinz、Hofer等一些著名學者卻對此持有異議,根據他們的實驗和經驗證明,乙酸酐和三乙醇胺液的處理並不能起到減低背景的目的,不能改善ISHH的信/噪比例。
3.減低背景染色。和免疫細胞化學染色一樣ISHH實驗程序中,如何減低背景染色是一個重要的問題。ISHH中背景染色的形成是諸多因素構成的。雜交后(Posthybridization)的酶處理和雜交后的洗滌均有助於減低背景染色。預雜交(Prehybridization)是減低背景染色的一種有效手段。預雜交液和雜交液的區別在於前者不含探針和硫酸葡聚糖(Dextran sulphate)。將組織切片浸入預雜交液中可達到封閉非特異性雜交點的目的,從而減低背景染色。有的實驗室在雜交后洗滌中採用低濃度的RNA酶溶液(20μg/ml)洗滌一次,以減低殘留的和內源性的RNA酶,減低背景染色。
4.防止RNA酶的污染。由於在手指皮膚及實驗用玻璃器皿上均可能含有RNA酶,為防止其污染影響實驗結果,在整個雜交前處理過程都需戴消毒手套。所有實驗用玻璃器皿及鑷子都應於實驗前一日置高溫(240℃)烘烤以達到消除RNA酶的目的。要破壞RNA酶,其最低溫度必須在150℃左右。有條件的國外實驗室在消毒的玻璃器皿外包以錫箔紙以利於標記和防止取出時空氣污染。在無高溫消毒的烤箱時,亦可用國內出產的衛生蒸汽消毒鍋(山東新華醫療器材廠生產)。雜交前及雜交時所應用的溶液均需經高壓消毒處理。
雜交(Hybridisation),在ISHH,整個實驗周期是比較長的,實驗程序也比較繁雜,而雜交在ISHH整個實驗中可被認為是“短兵相接”的一步。雜交前的一切準備工作如增加組織通透性都是為了在雜交這一步驟中核酸探針能進入細胞或組織與其內的靶核苷酸相結合。因此,雜交是ISHH中關鍵的而且是最重要的一個環節。
雜交是將雜交液滴於切片組織上,加蓋硅化的蓋玻片。國內向正華等採用無菌的蠟膜代替硅化的蓋玻片也可獲得滿意的實驗結果。加蓋片的目的是防止孵育過程中的高溫(50℃左右)導致雜交液的蒸發。因此,也有為穩妥起見,在蓋玻片周圍加液體石蠟封固的,但作者認為這並不十分必要,因封固的石蠟在高溫下融解反易導致雜交液的污染,必要時可加橡皮泥封固蓋片四周。硅化的蓋玻片的優點是清潔無雜質,光滑不會產生氣泡和影響組織切片與雜交液的接觸,蓋玻片自身有一定重量能與有限的雜交液吸附達到覆蓋和防止蒸發的作用。在孵育時間較長時,為保證雜交所需的濕潤環境,可將復有硅化蓋玻片進行雜交的載片放在盛有少量5×SSC或2×SSC(standard saline citrate, SSC)溶液的硬塑料盒(要能防止高溫破壞)中進行孵育。雜交液的成分和預雜交液基本相同,所不同的是加入了標記的核酸探針和硫酸葡聚糖。
如前所述,雜交前的準備只是為雜交的成功奠定基礎,要獲得滿意的實驗結果,在雜交這一實驗過程中還須注意以下的環節。
①探針的濃度。很難事先確定每一種實驗探針的濃度,但要掌握一個原則,即探針濃度必須給予該實驗最大的信/噪比值。背景染色的高低也與探針濃度有關。根據國內外實驗工作者的經驗,認為最佳原則應是應用最低探針濃度以達到與靶核苷酸的最大飽和結合度為目的。這和我們在免疫細胞化學試驗中選擇抗血清的最佳工作濃度的原則一樣。探針濃度依其種類和實驗需要略有不同,根據筆者的經驗及所查閱文獻,在原位雜交細胞化學中,探針濃度為0.5~5.0μg/ml(即0.5~5.0ng/μl)。
根據Heinz、Hofelt實驗室經驗,對放射性標記的dsDNA或cRNA探針,其濃度在2~5ng/μl。Conlton認為生物素標記探針,其最佳濃度在0.5~5ng/μl。作者在英皇家研究生院Polak教授實驗室應用於放射性標記cRNA探針的濃度為0.5ng/μl,而在非放射性標記(生物素或地高辛) cRNA探針濃度為2.5ng/μl,放射性標記DNA探針濃度為1.0ng/μl。向正華等應用地高辛標記生長抑素cRNA探針獲得滿意結果,其探針濃度為0.5ng/μl。必須強調的是,國內外實驗室都證明加雜交液的量要適當,以10~20μl/每張切片為宜。雜交液過多不僅造成浪費,而且液量過多常易致蓋玻片滑動脫落,影響雜交效果,過量的雜交液含核酸探針濃度過高,反易導致高背景染色等不良後果。
②探針的長度。一般應用於ISHH探針的最佳長度應在50~100個鹼基之間。探針短易進入細胞,雜交率高,雜交時間短。據報告,長500個鹼基的探針,其雜交時間約需20h左右。200~500個鹼基的探針仍可應用,如超過500個鹼基的探針則在雜交前最好用鹼或水解酶進行水解,使其變成短的片段,達到實驗所需求的鹼基數。
③雜交的溫度和時間。雜交的溫度也是雜交成功與否的一個重要環節。在第十八章概述中曾提到DNA或RNA需加熱或變性、解鏈后才能進行雜交。能使50%的核苷酸變性解鏈所需的溫度,叫解鏈溫度或融解溫度(melting temperature, 簡稱Tm)。原位雜交中,多數DNA探針需要的Tm是90℃,而RNA則需要95℃。這種高溫對保存組織形態完整和保持組織切片粘附在載玻片上是不可能的。因此,在雜交的程序中常規的加入30%~50%甲醯胺(for-mamide)於雜交液中。McConaughy報告,反應液中每增加1%的甲醯胺濃度,Tm值可降低0.72℃。因此,可用調節鹽濃度的辦法來調節Tm。Tm的計算公式在第十九章有介紹,由公式的列出也表明了它與鹽的濃度、探針的長度、甲醯胺的百分比等諸多因素有關。
由於鹽和甲醯胺濃度的調節等因素,實際採用的原位雜交的溫度在Tm-25℃左右,即比Tm減低25℃,大約在30~60℃之間,根據探針的種類不同,溫度略有差異,RNA和cRNA探針一般在37~42℃左右,而DNA探針或細胞內靶核苷酸為DNA的,則必須在80~95℃加熱使其變性,時間5~15min,(有作用報告在105℃微波爐加熱使之變性),然後在冰上擱置1min,使之迅速冷卻,以防復性,再置入盛有2×SSC的溫盒內,在37~42℃孵育雜交過夜。雜交的時間如過短會造成雜交不完全,而過長則會增加非特異性染色。從理論上講,核苷酸雜交的有效反應時間在3h左右。Barns等(1987)報告用DNA探針雜交,其反應完成時間為2~4h。但為穩妥起見,一般將雜交反應時間定為16~20h,或為簡便起見雜交孵育過夜,從現有文獻報告看無不良結果。當然,雜交反應的時間與核酸探針長度與組織通透性有關,在確定雜交反應時間應予考慮,並經反覆實驗確定。有作者主張雜交反應的孵育應在黑暗環境中進行,因為光線會促進甲醯胺的電離作用。
④雜交嚴格度(Hybridization stringency)。雜交條件的嚴格度(stringency)表示通過雜交及沖洗條件的選擇對完全配對及不完全配對雜交體的鑒別程度。錯配對(mismatch)雜交的穩定性較完全配對雜交體差,因此,通過控制雜交溫度、鹽濃度等,可減弱非特異性雜交體的形成,提高雜交的特異性。所以,雜交的條件愈高,特異性愈強,但敏感性降低,反應亦然。一般來說,低嚴格度(low stringency)雜交及沖洗條件在Tm-35℃至Tm–40℃之間,高鹽或低甲醯胺濃度。在這種條件下,大約有70%~90%的同源性核苷酸序列被結合,其結果是導致非特異性雜交信號的產生。中嚴格度, Tm -20℃至Tm-30℃的範圍。高嚴格度(high stringency)為Tm-10℃至Tm-15℃,低鹽和高甲醯胺濃度。
在這種條件下,只有具有高同源性的核苷酸序列才能形成穩定的結合。麥躍行裝用地高辛標記原位雜交技術檢測尖銳濕疣中人乳頭瘤病毒DNA型別,結果發現在嚴格條件下(Tm-12℃)各型病毒DNA的檢出率和陽性率明顯低於非嚴格條件下(Tm-35℃),其相差非常明顯(P<0.001)。因為,在嚴格條件下只有同源性很強的DNA才被檢出,而在非嚴格條件下同源性較低的DNA序列也被檢出。因此,他建議對病毒DNA分型需在高嚴格條件下進行,而低嚴格條件則可用於對病毒感染進行篩選。由於原位雜交技術多數是在Tm-25℃進行的,不屬於高嚴格範圍,無疑會產生非特異性結合導致信/噪比減低。在這種情況下,可用加強雜交后處理洗滌的嚴格度使非特異性的雜交體減少。
由於RNA雜交的穩定性,應用cRNA探針進行細胞或組織的原位雜交時的雜交溫度比其它核酸探針要高10~15℃。實驗證明,cRNA產生的信號比雙鏈cDNA要強。單鏈的RNA探針其雜交信號大於雙鏈的cDNA的約8倍。
⑤硫酸葡聚糖(Dextran sulphate)和甲醯胺(formamide)。硫酸葡聚糖是核酸雜交液中僅次於甲醯胺的一種組成成份。在雜交液中,甲醯胺佔50%左右,而硫酸葡聚糖佔10%左右。它是一種大分子的多聚胺化合物,具有極強的水合(hydrate)作用,因而能大大增加雜交液的粘稠度。硫酸葡聚糖的主要作用是促進雜交率,特別是對雙鏈核酸探針。這是應用硫酸葡聚糖於雜交液中的主要目的。甲醯胺的主要作用在上節已提及,在調節雜交反應溫度方面,甲醯胺起了極為重要的作用,從而有助於保持組織的形態結構。甲醯胺還可防止在低溫時非同源性片段的結合,但甲醯胺具有破壞氫鍵的作用從而具有一種不穩定的作用。
雜交后處理包括系列不同濃度,不同溫度的鹽溶液的漂洗。在原位雜交組織化學的實驗程序中,這也是一個重要的環節。特別因為大多數的原位雜交實驗是在低嚴格度條件下進行的,非特異性的探針片段粘附在組織切片上,從而增強了背景染色。RNA探針雜交時產生的背景染色特別高,但能通過雜交后的洗滌有效地減低背景染色,獲得較好的反差效果。在雜交后漂洗中的RNA酶液洗滌能將組織切片中非鹼基配對RNA除去。洗滌的條件如鹽溶液的濃度、溫度、洗滌次數和時間因核酸探針的類型和標記的種類不同而略有差異,一般遵循的共同原則是鹽溶液濃度由高到低而溫度由低到高。必須注意的是在漂洗的過程中,切勿使切片乾燥。乾燥的切片即使大量的溶液漂洗也很難減少非特異性結合,從而增強了背景染色。放射性標記探針雜交后漂洗過程中可用底片曝光的方法檢測背景染色(非特異性標記的多少)作為改善漂洗程序的指針。在35S標記的核酸探針在漂洗液中須加入14mmol/L的β-巰基乙醇(β-mercaptoethanol)或硫代硫酸鹽(thiosulphate),以防止35S標記的核酸探針被氧化。總之,如何控制漂洗的嚴格度從而達到理想的信/噪比無既定方案可循,必須從反覆的實踐中取得經驗。
顯示又可稱為檢測系統(Detection system)。根據核酸探針標記物的種類分別進行放射自顯影或利用酶檢測系統進行不同顯色處理。細胞或組織的原位雜交切片在顯示后均可進行半定量的測定,如放射自顯影可利用人工或計算機輔助的圖象分析檢測儀(computer– assisted image analysis)檢測銀粒的數量和分佈的差異。非放射性核酸探針雜交的細胞或組織可利用酶檢測系統顯色,然後利用顯微分光光度計或圖像分析儀對不同類型和數量的核酸的顯色強度進行檢測。但利用ISHH做半定量測定必須注意嚴格控制實驗的同一條件,切片的厚度和核酸的保存量如取材固定的間隔時間等。如為放射自顯影,核乳膠膜的厚度與稀釋度等必須保持一致。
以菌落原位雜交為例:
對分散在若干個瓊脂平板上的少數菌落(100-200)進行克隆篩選時,可採用該方法。將這些菌落歸併到一個瓊脂主平板以及已置於第二個瓊脂平板表面的一張硝酸纖維素濾膜上。經培養一段時間后,對菌落進行原位裂解。主平板應貯存於4℃直至得到篩選結果。
1. 將少數菌落轉移到硝酸纖維素濾膜上
(1) 在含有選擇性抗生素的瓊脂平板上放一張硝酸纖維素濾膜。
(2) 用無菌牙籤將各個菌落先轉移至濾膜上,再轉移至含有選擇性抗生素但未放濾膜的瓊脂主平板上。應按一定的格子進行劃線接種(或打點)。每菌落應分別劃線於兩個平板的相同位置上。最後,在濾膜和主平板上同時劃一個含有非重組質粒(如pBR322)的菌落。
(3) 倒置平板,於37℃培養至劃線的細菌菌落生長到0.5-1.0mm的寬度。
(4) 用已裝防水黑色繪圖墨水的注射器針頭穿透濾膜直至瓊脂,在3個以上的不對稱位置作標記。在主平板大致相同的位置上也作上標記。
(5) 用Parafilm膜封好主平板,倒置貯放於4℃,直至獲得雜交反應的結果。
(6) 裂解細菌,按本段下面所述方法,使釋放的DNA結合於硝酸纖維素濾膜。
2. 菌落的裂解及DNA結合於硝酸纖維素濾膜
(1) 在一張保鮮膜上製作一個裝有0.5mol/L NaOH的小窪(0.75ml),使菌落面朝上,將濾膜放到小窪上,展平保鮮膜,使濾膜均勻濕潤,讓濾膜留於原處2-3分鐘。 (2) 用干紙巾從濾膜的下方吸干濾膜,用一張新的保鮮膜和新配製的0.5mol/L NaOH重複步驟(1)。
(3) 吸干濾膜,將濾膜轉移到新的帶有1mol/L Tris·Cl(pH7.4)的保鮮膜窪上。5分鐘后吸干濾膜,再重複一次該步驟。
(4) 吸干濾膜,把它轉移到有1.5mol/L NaCl、0.5mol/L Tris·Cl (pH7.4)的保鮮膜小窪上5分鐘后吸干濾膜,轉移到一張乾的濾紙上,置於室溫20-30分鐘,使濾膜乾燥。 (5) 將濾膜夾在兩張乾的濾紙之間,在真空烤箱中於80℃干烤2小時,固定DNA。
(6) 將固定在膜上的DNA與32 P標記的RNA進行雜交。
3.雜交
(1) 盛有2×SSC的塑料盤同,將干烤的濾膜飄浮在液面上,徹底浸濕5分鐘。
(2) 將濾膜轉到200ml預洗液的玻璃皿中。濾膜何疊在一起,放於溶液中。用保鮮膜蓋住玻璃皿,放到位於培養箱內的旋轉平台上。於50℃處理30分鐘。在這一步及以後的所有步驟中,應緩緩搖動濾膜,防止它們粘在一起。
(3) 用泡過預洗液的吸水棉紙輕輕地從膜表面拭去細菌碎片,以降低雜交背景而不影響陽性雜交信號的強度和清晰度。
(4) 將濾膜轉到盛有150ml預雜交液的玻璃中,在適宜溫度(即在水溶液中雜交時用68℃,而在50%甲醯胺中雜交時用42℃)下,預雜交1-2小時。
(5) 將32 P標記的雙鏈DNA探針於100℃加熱5分鐘,迅速置於冰浴中。單鏈探針不必變性。將探針加到雜交袋中雜交過夜。雜交期間,盛濾膜的容器應蓋嚴,以防液體蒸發。
(6) 雜交結束后,去除雜交液,立即於室溫把濾膜放入大體積(300-500ml)的2×SSC和0.1% SDS溶液中,輕輕振搖5分鐘,並將濾膜至少翻轉一次。重複洗 一次,同時應避免膜乾涸。
(7)68℃用300-500ml 1×SSC和0.1% SDS溶液洗膜兩次,每次1-1.5小時。此時已可進行放射自顯影。如背景很高或實驗要求嚴格的洗膜條件,可用300-500ml 0.2×SSC和0.1% SDS的溶液於68℃將濾膜浸泡60分鐘。
(8) 把濾膜放在紙巾上於室溫晾乾后,把濾膜(編號面朝上)放在一張保鮮膜上,並在保鮮膜上作幾個不對稱的標記,以使濾膜與放射性自顯影片位置對應。
(9) 用第二張保鮮膜蓋住濾膜。加X光片並加上增感屏於-70℃曝光12-16小時。
(10) 底片顯影后,在底片上貼一張透明硬紙片。在紙上標記陽性雜交信號的位置,同時在不對稱分佈點的位置上作出標記。可從底片上取下透明紙,通過對比紙上的點與瓊脂上的點來鑒定陽性菌落。
收集斑馬魚的胚胎,在Holfretor水中培養,到達所需要的發育時期時,用蛋白酶去除卵膜,用4%多聚甲醛固定,在4℃保存,二十四小時後用50%甲醇2%多聚甲醛溶液洗,然後換成甲醇,在-20C 保存,待用(兩天和兩天以上的胚胎需要用雙氧水處理,去除色素。或者使用苯鋶脲稀溶液培養,可阻斷色素的形成)
一. 原位雜交第一天
1. 重新水化和固定
1)吸取固定好的胚胎,加入50%甲醇的PBST溶液,放置5分鐘。
2)置換成30%甲醇的PBST溶液,放置5分鐘
3)置換成PBST溶液,放置5分鐘,重複一次
4)置換成4%多聚甲醛的PBS溶液固定20分鐘
5)用PBST洗兩次,每次放置五分鐘,室溫。
蛋白酶處理與后固定(本實驗不做此步)
1)用10ul/ml的蛋白酶K在室溫下處理胚胎。5體節以下的胚胎不處理,5體節到24小時的胚胎處理3分鐘,24小時以上的胚胎處理5分鐘或者更長。發育時間越短的胚胎越嫩,可以不用或者少用蛋白酶處理,發育時間長的胚胎就需要用蛋白酶來疏鬆組織,以便於雜交。
2)用PBST溶液輕洗,在PBST中放置5分鐘。
3)用4%多聚甲醛的PBS溶液固定20分鐘,室溫。
4)用PBST洗兩次,每次放置五分鐘,室溫。
2. 預雜交
1)每個管中置換成大約300ulHYB-溶液,60℃水浴5分鐘,避免振蕩。
2)用等體積的HYB+取代HYB-。
3)60℃水浴,預雜交4小時以上。
3. 雜交
1)吸去預雜交的HYB+,加上100ul已加入探針的HYB+溶液(探針濃度約為1ng/ul)..
2)60℃ 溫浴過夜。
註:雜交與預雜交的溫度可以是55到60度不等,溫度越低,探針結合越好,溫度越高,背景越小。
二. 原位雜交第二天
1.
1)將探針回收,放於-20C保存(通常探針可重複使用十次左右)。
2)加入50%甲醯胺/2XSSCT溶液1毫升,60℃,放置30分鐘,重複一次。
3)置換2XSSCT1ml,60℃,放置15分鐘。
4)置換0.2XSSCT1ml,60℃,放置30分鐘,重複一次。
2.
1)用MABT洗兩次,每次五分鐘,放在搖床輕輕搖動。
2)室溫下加1ml 1:2:7溶液,時間為一小時。
3)按1:3000的比例在1:2:7溶液中加入酶連地高辛抗體,4C 冰箱過夜。
三. 原位雜交第三天
1)用1ml含10%熱滅活血清的MABT溶液置換抗體溶液,放置搖床上25分鐘,然後用1mlMABT置換,25分鐘,再用1mlMABT溶液置換,一小時以上,最後用1mlMABT溶液置換,25分鐘。
2)用1ml 1mM左旋米睉的Staining buffer洗三次,每次放置五分鐘。
3)將胚胎轉入十六孔板中,吸去staining buffer,加上300ul BM Purple AP Substrate(底物,用之前加5mM左旋米唑),十六孔板外麵包上錫箔紙以避光,避免搖動,室溫下顯色。
4)每隔一小時觀察胚胎是否開始顯色
5)將顯色完全的胚胎中的底物吸出,用PBST洗兩三次后加上4%多聚甲醛固定,拍照。
6)4C冰箱保存。
原位雜交中溶液的配製:
PBS:
NaCl 8g
KCl 0.2g
Na2HPO4 1.44g
KH2PO4 0.24g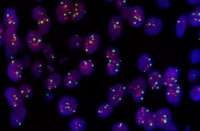

原位雜交
DEPC H2O 1L
HCl 調PH值至7.4
抽濾,滅菌
4% 多聚甲醛:
多聚甲醛 40g
PBS 1L
加熱持續攪拌至溶液澄清。-20℃保存
PBST:
PBS溶液加上Tween-20使其終濃度為0.1%。
20XSSC:
Na3Citrate 2H2O 88.2g
NaCl 175.5g
DEPC H2O 至1L
抽濾,滅菌
SSCT:
SSC加上Tween-20使其終濃度為0.1%。
HYB-:
甲醯胺:20XSSC儲液:DEPC水=2:1:1配製
加入Tween-20使其終濃度為0.1%,-20c保存。
HYB+:
HYB- 20ml
yeast RNA 10mg
heparin 1mg。
-20℃保存。
MAB:
maleic acid 11.6g
NaCl 8.8g
用固體NaOH(約7g)調至Ph=7.5
4℃保存
MABT
MAB加上Tween-20使其終濃度為0.1%.
10% blocking reagent:
blocking reagent 8g
MAB 72ml
1:2:7溶液:
滅活羊血清:10% BM blocking reagent:MABT=1:2:7
用時現配
Staining buffer:
Tris 12.1g
pH9.5
Mgcl 6H2O 10.2g,
Nacl 5.85g
Tween-20 1ml,
用之前加1M的左旋咪唑儲液,使之終濃度為1mM。
①細胞特異性mRNA轉錄的定位,可用於基因圖譜,基因表達和基因組進化的研究;
②感染組織中病毒DNA/RNA的檢測和定位,如EB病毒mRNA、人類乳頭狀瘤病毒和巨細胞病毒DNA的檢測;
③癌基因、抑癌基因及各種功能基因在轉錄水平的表達及其變化的檢測;
④基因在染色體上的定位;
⑤檢測染色體的變化,如染色體數量異常和染色體易位等;
原位雜交:在研究DNA分子複製原理的基礎上發展起來的一種技術。其基本原理是兩條核苷酸單鏈片段,在適宜的條件下,能過氫鍵結合,形成DNA-DNA、DNA-RNA或 RNA-RNA 雙鍵分子的特點,應用帶有標記的(有放射性同位素,如3H、35S、32P、熒光素生物素、地高辛等非放射性物質)DNA或RNA片段作為核酸探針,與組織切片或細胞內待測核酸(RNA或DNA)片段進行雜交,然後可用放射自顯影等方法予以顯示,在光鏡或電鏡下觀察目的 mRNA或DNA 的存在並定位;用原位雜交技術,可在原位研究細胞合成某種多肽或蛋白質的基因表達。此方法有很高的敏感性和特異性,可進一步從分子水平來探討細胞的功能表達及其調節機制。已成為當今細胞生物學、分子生物學研究的重要手段。
對照試驗和ISHH結果判斷,和其它實驗方法一樣,並非ISHH的任何陽性信號都是特異性的,故必須同時有對照試驗以證明其特異性。對照試驗的設置須根據核酸探針和靶核苷酸的種類和現有的可能條件去選定。從理論上講,對照試驗設置愈多其靶核苷酸特異性確定愈可靠,但現實是不可能的。因此,在上述對照試驗中應任選設至少3~4種用以證實ISHH結果的可靠性。在上述試驗中,標明*者為比較可靠的對照試驗。
①Northern 和 southern印跡雜交法證明的方式和用western印跡法檢測抗體(蛋白質)的特異性一樣,是比較可靠的。
②如果具備相當的免疫組化抗血清,可用結合的免疫組織化學和ISHH法從蛋白質(或多肽)水平和轉錄水平在相鄰切片或同一切片中證明同一種多肽和相應mRNA共存於同一細胞中。
③預先將切片用 DNA酶或RNA酶消化,然後用ISHH技術證明丟失的是DNA或RNA。如同免疫組化的吸收試驗一樣,事先與特異性的cRNA或cDNA進行雜交。再進行ISHH,其結果應為陰性。由於同義RNA探針和組織內 mRNA序列順序是相同的,應用其進行ISHH,結果應為陰性。
④檢測系統的對照如乳膠或酶顯色系統也應在無標記探針的情況下進行。 ISHH的最大優點是它的高度特異性,它可測定組織、培養的單個細胞或細胞提取物中的核苷酸含量。應用高敏感度的放射性標記cRNA探針在理想的ISHH的實驗條件下檢測mR-NA,其敏感度可達到20個mRNA拷貝/每個細胞。由於雙鏈DNA的穩定性,在用ISHH定位DNA時很少發生丟失,降解。在靶核苷酸序列比較伸展的情況如染色體鋪片,長於2kb的探針可以應用。因此,其敏感性高到能夠出在染色體鋪片上,有時甚至在組織切片上的單個基因拷貝。正因為如此,對ISHH結果的解釋應持慎重態度,特別是前人未報告過的新發現。因為如前所述,影響ISHH實驗結果的因素太多,比如在外科或實驗取材后未及時的固定或冷凍可由於組織中mRNA的降解而導致假陰性結果。另外,在各種類型核酸探針進入細胞、組織和各種器官的能力,又叫可接近性(acessiblity)各異。這些諸多因素都將影響ISHH的實驗結果。
熒光原位雜交(fluorescence in situ hybridization,FISH)是在20世紀80年代末在放射性原位雜交技術的基礎上發展起來的一種非放射性分子細胞遺傳技術,以熒游標記取代同位素標記而形成的一種新的原位雜交方法,探針首先與某種介導分子(reporter molecule)結合,雜交后再通過免疫細胞化學過程連接上熒光染料,FISH的基本原理是將DNA(或RNA)探針用特殊的核苷酸分子標記,然後將探針直接雜交到染色體或DNA纖維切片上,再用與熒光素分子偶聯的單克隆抗體與探針分子特異性結合來檢測DNA序列在染色體或DNA纖維切片上的定性、定位、相對定量分析.FISH具有安全、快速、靈敏度高、探針能長期保存、能同時顯示多種顏色等優點,不但能顯示中期分裂相,還能顯示於間期核。同時在熒光原位雜交基礎上又發展了多彩色熒光原位雜交技術和染色質纖維熒光原位雜交技術.