鹽皮質激素
鹽皮質激素
鹽皮質激素(mineralocorticoid)是由腎上腺皮質球狀帶細胞分泌的類固醇激素,主要生理作用是維持人體內水和電解質的平衡;水是人體的重要組成部分。人體內的水亦稱體液。在成年男性,體液佔總體重的60%,成年女性佔55%。其中大約40%分佈在細胞內,稱為細胞內液,其餘部分為細胞外液,包括血液、組織間液、腦脊液、胸腹腔液及關節腔液等。人體每日排出的尿液約1000-2000毫升,經皮膚、呼吸及大便中排水約1000毫升,帶出體內產生的廢物;同時也要攝入相當量的水予以補充。可以說,幾乎人體內所有的生命活動都在水中進行,並通過水進行新陳代謝。因此,保持體液量的衡定及細胞內、外液的交流意義十分重大。
自然界的水都不是純水,均含有不同量的可溶於水的物質。最常見的是電解質,它是帶有正負電荷的離子(氫、鉀、鈉、鈣、鎂等陽離子,氯、磷、碳酸氫根等陰離子)及一些有機物質(蛋白質、有機酸等),統稱為溶質。細胞內液的溶質以鉀離子為主,細胞外液的溶質以鈉、氯離子為主。
鹽皮質激素的主要生理作用是促進腎小管重吸收鈉而保留水,並排泄鉀。它與下丘腦分泌的抗利尿激素相互協調,共同維持體內水、電解質的平衡。鹽皮質激素的保鈉排鉀作用也表現在唾液腺、汗腺及胃腸道。
在天然皮質激素中,醛固酮是作用最強的一種鹽皮質激素。其理鹽作用是等量糖皮質激素(皮質醇)的500倍。在正常生理狀態下,由於糖皮質激素的分泌量很大,故在人體總的理鹽效應中由糖皮質激素承擔的約佔45%,醛固酮也承擔45%,另一種鹽皮質激素脫氧皮質酮承擔10%。平時每日醛固酮的分泌量很少,如因某種情況引起醛固酮分泌過多,其顯著的鈉水瀦留及排鉀效應則可引起低血鉀、組織水腫、高血壓。若鹽皮質激素分泌水平過低會導致水鈉流失和血壓降低的癥狀。
鹽皮質激素與腎臟病,鹽皮質激素(mineralocorticoid,Mc)是調節機體水鹽代謝的重要一類激素,在人類中該類激素主要為醛固酮(aldosteronen,Aldo)。目前這類激素早已為人們所熟知,但其作用機制並未完全明了。近年來研究發現,醛固酮與高血壓、臟器纖維化等病變密切相關,故有關醛固酮的多方面、多層次研究仍然方興未艾。現在我們已經知道,不僅醛固酮及其受體的異常可引起某些腎臟病變或高血壓,而且醛固酮可作為一個獨立的致病因素直接參與腎臟纖維化的過程。
一、鹽皮質激素及其受體
醛固酮主要由腎上腺皮質球狀帶合成及分泌,平均分泌量為100~200/zg/d,血漿濃度為0.1~l nmoI/L,主要在肝臟代謝排出。此外,心臟、血管等組織也能合成醛固酮,並以自分泌和(或)旁分泌的形式發揮作用,可能參與了局部病理、生理過程,如纖維化等。醛固酮合成原料為膽固醇,經多種細胞色素P450及短鏈脫氫酶的催化作用而形成,其中最為關鍵的限速酶為醛固酮合成酶(cYP1B2),可催化皮質酮轉變為醛固酮。cYP1B2由常染色體8q21-22中cYP1B2基因編碼,該基因的轉錄受血管緊張素Ⅱ及血鉀的調節。當血中血管緊張素Ⅱ水平升高后,即與球狀帶細胞上特異性I型受體結合,激活磷脂酶c,啟動磷酸肌醇通路,使細胞內鈣離子濃度升高,通過鈣調素和鈣調素激酶激活cAMP反應元件結合蛋白,後者能與醛固酮合成酶基因啟動子中的cAMP反應元件相結合,進而促進醛固酮合成酶的基因轉錄和蛋白合成,導致醛固酮分泌增加。另外,血鉀升高也能促進細胞外鈣離子進入細胞內,通過上述細胞途徑直接促進醛固酮分泌。ACTH對醛固酮的調節作用在生理狀態下並不明顯,但應激時也能通過cAMP和蛋白激酶A激活cAMP反應元件結合蛋白,促進醛固酮分泌。
醛固酮的生物作用主要由鹽皮質激素受體(mineraloc·0rticoid receptor,MR)介導。類固醇激素受體屬於核受體大家族,同類受體還包括視黃酸受體、甲狀腺素受體及維生素D受體等。它們的基本結構很相似,均包含3個功能結構域,即活化基因轉錄的N端結構域、與DNA位點結合的中間結構域以及與配體結合的c端結構域。
N端的結構在不同核受體中變化很大,同源性<15%。該區是受體磷酸化的主要部位,並含有與轉錄活化有關的結構域,稱為活化功能1區(AFl)或Taul區。N端結構域同時也是受體與其他轉錄因子相結合的部位。高度保守的DNA結合區是核受體家族的主要特徵,其結構組成目前已經清楚。該區由66~68個氨基酸組成,含有9個位置保守的半胱氨酸。其中前8個半胱氨酸分別與兩個鋅原子作用,形成兩個鋅指結構。每個結構由12~13個氨基酸組成,間隔15~1 7個氨基酸。在靠近N端的第一個鋅指結構中,其基底部c端螺旋處含有3~4個重要的氨基酸,稱為P盒,主要參與靶基因上特異性DNA序列的識別並與之結合。另一個鋅指結構與DNA結合的特異性較差,但能增加前者與DNA結合的親和力,其基底部也含有5個氨基酸,稱為D盒,主要提供界面以便受體與其他蛋白質結合形成二聚體。c端的配體結合區也較為保守,富含疏水序列,由200~250個氨基酸組成,形成ll~12個螺旋結構,可提供與配體結合的特異性位點。其c端具有配體誘導的轉錄活化功能,稱為AFz區。另外,該結構域還參與受體的核內定位,並促進同形二聚體的形成。對於類固醇激素受體,此區也是與熱休克蛋白結合的部位。
非活化的MR主要位於胞質中,與兩分子熱休克蛋白相結合。一旦醛固酮與MR結合后,即可引起受體構型發生改變,脫去熱休克蛋白,形成二聚體,並激活核定位信號,使活化的受體配體複合物迅速轉移至核內。隨後DNA結合區暴露,鋅指頂端與靶基因上磷酸基團結合,識別特異性DNA序列並與之緊密結合,通過RNA聚合酶Ⅱ直接影響基因轉錄;或者通過與其他轉錄因子的作用,間接調節基因轉錄,進而產生一系列醛固酮誘導蛋白髮揮作用,但是受醛固酮調控的確切基因目前知之甚少。據報道在醛固酮作用的最初40 mln內,遠端腎單位上皮細胞中約O.5%的基因轉錄可受其影響。此外,醛固酮的部分作用還可由細胞內信號傳遞系統介導,引起細胞內鈣離子、cAMt,和cGMP等改變,快速影響靶細胞的功能。近來在人的單核細胞、豬的肝臟和腎臟等多個部位已發現有醛固酮膜結合位點,親和係數約為0.1nmol/L,可能介導了醛固酮的快速細胞作用。已有人在豬的肝臟微粒體中分離和克隆出孕酮的膜結合蛋白,這可能是第一個類固醇激素膜受體。
自然界的水都不是純水,均含有不同量的可溶於水的物質。最常見的是電解質,它是帶有正負電荷的離子(氫、鉀、鈉、鈣、鎂等陽離子,氯、磷、碳酸氫根等陰離子)及一些有機物質(蛋白質、有機酸等),統稱為溶質。細胞內液的溶質以鉀離子為主,細胞外液的溶質以鈉、氯離子為主。
鹽皮質激素的主要生理作用是促進腎小管重吸收鈉而保留水,並排泄鉀。它與下丘腦分泌的抗利尿激素相互協調,共同維持體內水、電解質的平衡。鹽皮質激素的保鈉排鉀作用也表現在唾液腺、汗腺及胃腸道。
在天然皮質激素中,醛固酮是作用最強的一種鹽皮質激素。其理鹽作用是等量糖皮質激素(皮質醇)的500倍。在正常生理狀態下,由於糖皮質激素的分泌量很大,故在人體總的理鹽效應中由糖皮質激素承擔的約佔45%,醛固酮也承擔45%,另一種鹽皮質激素脫氧皮質酮承擔10%。平時每日醛固酮的分泌量很少,如因某種情況引起醛固酮分泌過多,其顯著的鈉水瀦留及排鉀效應則可引起低血鉀、組織水腫、高血壓。若鹽皮質激素分泌水平過低會導致水鈉流失和血壓降低的癥狀。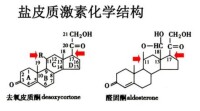

鹽皮質激素
1.醛固酮
(1)醛固酮的合成與代謝
醛固酮是在1953年發現的一種類固醇激素,是由膽固醇經一系列酶促反應,最後由醛固酮合成酶催化而成。醛固酮合成酶由CYP11B2基因編碼,該基因位於小鼠的15號染色體以及人類8號染色體長臂8q22上。除腎上腺外,心血管系統、中樞神經系統也表達CYP11B2酶,提示局部組織可以合成醛固酮並作用於相應的靶器官。醛固酮的代謝在肝臟中進行,主要被還原成四氫醛固酮,與葡萄糖醛酸結合后隨尿排出。
(2)醛固酮的作用與調節
醛固酮主要促進腎臟保鈉排鉀,以維持水鹽平衡。它的另一重要作用是以自分泌或旁分泌方式與局部組織的MR結合,調控靶器官功能。醛固酮可通過基因組的作用,即與胞內受體結合,調節不同靶基因表達和蛋白翻譯;或者通過非基因組的快速作用,即不依賴胞內受體及轉錄和翻譯的過程產生效應,該作用不被螺內酯等醛固酮受體拮抗劑所阻斷。目前對醛固酮非基因組效應的研究越來越多,已發現醛固酮的非基因組信號通路涉及環磷酸腺苷(cAMP)、三磷酸肌醇(IP3)、鈣離子(Ca2+)、蛋白激酶C(PKC)、細胞外信號調節激酶(ERK1/2)、磷脂醯肌醇3-激酶(PI3K)、非受體酪氨酸激酶(c-src)、血管緊張素Ⅱ(AngⅡ)、表皮生長因子受體(EGFR)、NADPH氧化酶/活性氧(ROS)、一氧化氮合成酶(NOS)、Na+/H+交換蛋白(NHE)等。
2.脫氧皮質酮(DOC)
DOC也是一種重要的鹽皮質激素,由腎上腺產生並作為醛固酮的前體。現在研究發現,DOC既是一種強效鹽皮質激素,也具有糖皮質激素的作用。DOC由孕酮經21α-羥化酶催化而成,其分泌速率與醛固酮大致相同,促腎上腺皮質激素、AngⅡ及K+可影響其分泌。DOC在肝臟中代謝,還原為四氫脫氧皮質酮,與葡萄糖醛酸相結合,排泄到尿液中。DOC在生理濃度時幾乎不發揮生物學效應,當體內DOC分泌過多時,產生很強的鹽皮質激素作用,發生高血壓及低血鉀等類似醛固酮表現。DOC致高血壓的作用已被廣泛認可,這種效應也被用於誘導實驗性高血壓模型。

鹽皮質激素
醛固酮主要由腎上腺皮質球狀帶合成及分泌,平均分泌量為100~200/zg/d,血漿濃度為0.1~lnmoI/L,主要在肝臟代謝排出。此外,心臟、血管等組織也能合成醛固酮,並以自分泌和(或)旁分泌的形式發揮作用,可能參與了局部病理、生理過程,如纖維化等。醛固酮合成原料為膽固醇,經多種細胞色素P450及短鏈脫氫酶的催化作用而形成,其中最為關鍵的限速酶為醛固酮合成酶(cYP1B2),可催化皮質酮轉變為醛固酮。cYP1B2由常染色體8q21-22中cYP1B2基因編碼,該基因的轉錄受血管緊張素Ⅱ及血鉀的調節。當血中血管緊張素Ⅱ水平升高后,即與球狀帶細胞上特異性I型受體結合,激活磷脂酶c,啟動磷酸肌醇通路,使細胞內鈣離子濃度升高,通過鈣調素和鈣調素激酶激活cAMP反應元件結合蛋白,後者能與醛固酮合成酶基因啟動子中的cAMP反應元件相結合,進而促進醛固酮合成酶的基因轉錄和蛋白合成,導致醛固酮分泌增加。另外,血鉀升高也能促進細胞外鈣離子進入細胞內,通過上述細胞途徑直接促進醛固酮分泌。ACTH對醛固酮的調節作用在生理狀態下並不明顯,但應激時也能通過cAMP和蛋白激酶A激活cAMP反應元件結合蛋白,促進醛固酮分泌。
醛固酮的生物作用主要由鹽皮質激素受體(mineraloc·0rticoidreceptor,MR)介導。類固醇激素受體屬於核受體大家族,同類受體還包括視黃酸受體、甲狀腺素受體及維生素D受體等。它們的基本結構很相似,均包含3個功能結構域,即活化基因轉錄的N端結構域、與DNA位點結合的中間結構域以及與配體結合的c端結構域。
N端的結構在不同核受體中變化很大,同源性<15%。該區是受體磷酸化的主要部位,並含有與轉錄活化有關的結構域,稱為活化功能1區(AFl)或Taul區。N端結構域同時也是受體與其他轉錄因子相結合的部位。高度保守的DNA結合區是核受體家族的主要特徵,其結構組成目前已經清楚。該區由66~68個氨基酸組成,含有9個位置保守的半胱氨酸。其中前8個半胱氨酸分別與兩個鋅原子作用,形成兩個鋅指結構。每個結構由12~13個氨基酸組成,間隔15~17個氨基酸。在靠近N端的第一個鋅指結構中,其基底部c端螺旋處含有3~4個重要的氨基酸,稱為P盒,主要參與靶基因上特異性DNA序列的識別並與之結合。另一個鋅指結構與DNA結合的特異性較差,但能增加前者與DNA結合的親和力,其基底部也含有5個氨基酸,稱為D盒,主要提供界面以便受體與其他蛋白質結合形成二聚體。c端的配體結合區也較為保守,富含疏水序列,由200~250個氨基酸組成,形成ll~12個螺旋結構,可提供與配體結合的特異性位點。其c端具有配體誘導的轉錄活化功能,稱為AFz區。另外,該結構域還參與受體的核內定位,並促進同形二聚體的形成。對於類固醇激素受體,此區也是與熱休克蛋白結合的部位。
非活化的MR主要位於胞質中,與兩分子熱休克蛋白相結合。一旦醛固酮與MR結合后,即可引起受體構型發生改變,脫去熱休克蛋白,形成二聚體,並激活核定位信號,使活化的受體配體複合物迅速轉移至核內。隨後DNA結合區暴露,鋅指頂端與靶基因上磷酸基團結合,識別特異性DNA序列並與之緊密結合,通過RNA聚合酶Ⅱ直接影響基因轉錄;或者通過與其他轉錄因子的作用,間接調節基因轉錄,進而產生一系列醛固酮誘導蛋白髮揮作用,但是受醛固酮調控的確切基因目前知之甚少。據報道在醛固酮作用的最初40mln內,遠端腎單位上皮細胞中約O.5%的基因轉錄可受其影響。此外,醛固酮的部分作用還可由細胞內信號傳遞系統介導,引起細胞內鈣離子、cAMt,和cGMP等改變,快速影響靶細胞的功能。近來在人的單核細胞、豬的肝臟和腎臟等多個部位已發現有醛固酮膜結合位點,親和係數約為0.1nmol/L,可能介導了醛固酮的快速細胞作用。已有人在豬的肝臟微粒體中分離和克隆出孕酮的膜結合蛋白,這可能是第一個類固醇激素膜受體。
