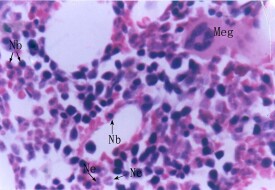
紅骨髓
紅骨髓
是存在於長骨(如肱骨、股骨)的骨髓腔和扁平骨(如髂骨)的稀鬆骨質間的網眼中,是一種海綿狀的組織,能產生血細胞的骨髓略呈紅色,稱為紅骨髓。
人出生時,紅骨髓充滿全身骨髓腔,隨著年齡增大,脂肪細胞增多,相當部分紅骨髓被黃骨髓取代,最後幾乎只有扁平骨骨髓腔中有紅骨髓。此種變化可能是由於成人不需全部骨髓腔造血,部分骨髓腔造血已足夠補充所需血細胞。成人的紅骨髓主要分佈在扁骨,不規則骨及長骨骨骺端的松質骨中,具有活躍的造血功能。當機體嚴重缺血時,部分黃骨髓可被紅骨髓替代,骨髓的造血能力顯著提高。
自體紅骨髓異位移植后,早期就出現造血細胞退化、變性、直到最後死亡、消失:與此同時,骨髓基質細胞受移植創傷刺激和局部環境因素影響,進行增殖,並分化成骨。先形成網織骨,后經塑形改造轉化為有髓腔的板層小骨。基質細胞還構成造血微環境,使經血流而來的造血幹細胞在此居留、分化、成熟。
自體植骨優於其它任何類型植骨,因此臨床上多選用自體骨。但在脊柱融合、填充創傷和腫瘤廣泛切除所造成的骨缺損時,自體骨顯然不能滿足需求,尤其在兒童和老年性骨質疏鬆患者。而且取自體骨需額外的外科手術,這就增加了感染的危險性和失血量,延長了手術時間和住院期限。於是人們一直在尋找自體骨的替代物,其中自體紅骨髓作為一種骨修復材料已被用於臨床。Salama首先用異種骨(Kiel骨)加取自自體髂骨的紅骨髓進行複合移植,前後報道兩次共治療126例骨不連、骨缺損病人,取得滿意療效。Graham報道10例骨不連患者經“異種骨-自體紅骨髓”複合植骨,也獲得堅實的骨性連接。在口腔外科領域內,Jackson等人用自體紅骨髓移植來閉合兒童齶骨缺損,其效果明顯優於皮質骨移植。現如今,自體紅骨髓移植用於骨科臨床的報道並不多。可望在未來,自體紅骨髓與(1)異體骨或異種骨:(2)BMG或BMP:(3)多孔有生物降解作用的骨替代物如陶瓷所組成的複合移植物將廣泛用於臨床,從而彌補自體植骨的不足並取而代之。這一目標若能實現,無疑將是骨外科領域的重大進展。
是能自我更新、有較強分化發育和再生能力、可以產生各種類型血細胞的始祖細胞。造血幹細胞來源於紅骨髓,可以經血流遷移到外周血液循環中,不會因獻血和捐獻造血幹細胞而損壞造血功能。
造血幹細胞(Stem cell,SC)的干,譯自英文“stem”,意為“樹”、“干”和“起源”。類似於一棵樹榦可以長出樹杈、樹葉,並開花和結果等。通俗地講,造血幹細胞是指尚未發育成熟的細胞,是所有造血細胞和免疫細胞的起源,它不僅可以分化為紅細胞、白細胞和血小板,還可跨系統分化為各種組織器官的細胞,具有自我更新、多向分化和歸巢(即定向遷移至造血組織器官)潛能。因此是多功能幹細胞,醫學上稱其為“萬用細胞”,也是人體的始祖細胞。幹細胞是具有自我複製和多向分化潛能的原始細胞,是機體的起源細胞,是形成人體各種組織器官的祖宗細胞。造血幹細胞有兩個重要特徵:其一,高度的自我更新或自我複製能力;其二,可分化成所有類型的血細胞。造血幹細胞採用不對稱的分裂方式:由一個細胞分裂為兩個細胞。其中一個細胞仍然保持幹細胞的一切生物特性,從而保持身體內幹細胞數量相對穩定,這就是幹細胞自我更新。而另一個則進一步增殖分化為各類血細胞、前體細胞和成熟血細胞,釋放到外周血中,執行各自任務,直至衰老死亡,這一過程是不停地進行著的。
經典學說認為,在胚胎的發育過程中,造血發生由卵黃囊、肝臟、脾臟最後到骨髓。在成體,造血發生主要在骨髓、脾臟和胸腺。血細胞發育的最早階段,發生於卵黃囊的血島處。在小鼠胚胎7.5天(人胚16天)造血首先見於胚外的卵黃囊血島,血島中央的細胞分化為最早的造血幹細胞,它們是由胚外中胚層的原始生殖細胞(primordialgermcells,PGCs)分化而來的,在血島血循環中,第一個可辨認的造血細胞出現在8-9天。當胚體建立循環后,造血幹細胞經血流遷入胚肝,肝臟取代卵黃囊成為造血的主要組織:到出生后,這一位置又移到了脾臟和骨髓。骨髓是終生造血器官,是造血細胞的主要產生地,造血幹細胞主要存在於紅骨髓。骨髓的造血微環境由骨髓基質細胞、細胞外基質和各種生長因子共同組成,是造血幹細胞維持最佳功能狀態的“壁龕”(niche),造血幹細胞在骨髓的造血微環境中宿居、增殖、分化,以維持造血組織的功能和血細胞數量的恆定〔1〕。作為造血組織中的核心成分,造血幹細胞具有高度的自我更新能力以及在適當條件下,向多個方向分化為各系造血細胞的潛能,並具有長期處於非增殖狀態的特性。正常情況下。造血幹細胞經過有絲分裂后,正常穩定狀態下約半數子細胞仍保持幹細胞的全部特性,即自我更新(self-renewal)。自我更新使得幹細胞池的大小(幹細胞數量)和質量維持不變,因而又稱為自我維持(seIf-maintenance)。另有半數的幹細胞有絲分裂過程中特徵發生改變走向逐漸分化的途徑,離開幹細胞池進入增殖分化池。從而維持了機體的正常造血,保證了機體在生命過程中對各類細胞的需要。造血幹細胞的分化是一個造血細胞數量逐步放大的過程,這些細胞逐步的分化成熟,經由造血祖細胞到形態可辨認的前體細胞,最終成熟而逐漸走向死亡。有實驗表明,造血幹細胞還能產生某些非造血細胞,如破骨細胞、肥大細胞及表皮生髮層星狀細胞等。此外,造血幹細胞的另一個生物學特性就是增殖潛能大,在正常生理情況下,每天由骨髓造血幹細胞產生約1×1011個血細胞釋放入血,以補充每天在衰老而死亡的血細胞,而人類骨髓中的幹細胞僅占骨髓單個核細胞的1/106~1/107,只需少數(<5%)造血幹細胞處於細胞周期,便能保證機體恆定的造血,一旦機體需要,可以有更多的造血幹細胞從G0期進入細胞周期。造血幹細胞的生物學特性還包括其靜止性、不均一性及具有一些特殊的表面標誌等。