基因工程載體
基因工程載體
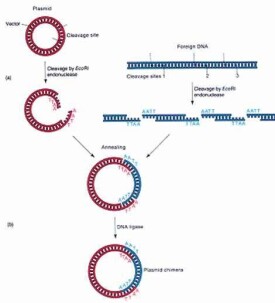
按人們的意願去有目的地改造,創建生物遺傳性,因此其最基本的工程就是要得到目的基因或核酸序列的克隆。分離或改建的基因和核酸序列自身不能繁殖,需要載體攜帶它們到合適的細胞中複製和表現功能。常用的載體有質粒,噬菌體和病毒等。
pUC18
對理想的基因工程載體一般至少有以下幾點要求:
①能在宿主細胞中複製繁殖,而且要有較高的自主複製能力。
②容易進入宿主細胞,而且進入效率越高越好。
③容易插入外來核酸片段,插入后不影響其進入宿主細胞和在細胞中的複製。這就要求載體DNA上要有合適的限制性核酸內切酶位點。每種酶的切位點只有一個。
④容易從宿主細胞中分離純化出來,這才便於重組操作。
⑤有容易被識別篩選的標誌,當其進入宿主細胞、或攜帶著外來的核酸序列進入宿主細胞都能容易被辨認和分離出來。這才介於克隆操作。
質粒(plasmid)是細菌或細胞染色質以外的,能自主複製的,與細菌或細胞共生的遺傳成分。
①是染色質外的雙鏈共價閉合環形DNA(covalently closed circuar DNA,cccDNA),可自然形成超螺旋結構,不同質粒大小在2-300 kb之間,15kb的大質粒則不易提取。
②能自主複製,是能獨立複製的複製子(autonomous replicon)。一般質粒DNA複製的質粒可隨宿主細胞分裂而傳給後代。按質粒複製的調控及其拷貝數可分兩類:嚴緊控制(stringent control)型質粒的複製常與宿主的繁殖偶聯,拷貝數較少,每個細胞中只有1個到十幾個拷貝;另一類是鬆弛控制(relaxed control)型質粒,其複製宿主不偶聯,每個細胞中有幾十到幾百個拷貝。每個質粒DNA上都有複製的起點,只有ori能被宿主細胞複製蛋白質識別的質粒才能在該種細胞中複製,不同質粒複製控制狀況主要與複製起點的序列結構相關。有的質粒的可以整合到宿主細胞染色質DNA中,隨宿主DNA複製,稱為附加體,例如細菌的性質粒就是一種附加體,它可以質粒形式存在,也能整合入細菌的DNA,又能從細菌染色質DNA上切下來。F因子攜帶基因編碼的蛋白質能使兩個細菌間形成纖毛狀細管連接的接合(conjugation),通過這細管遺傳物質可在兩個細菌間傳遞。
③質粒對宿主生存並不是必需的。這點不同於線粒體,線粒體DNA也是環狀雙鏈分子,也有獨立複製的調控,但線粒體的功能是細胞生存所必需的。線粒體是細胞的一部分,質粒也往往有其表型,其表現不是宿主生存所必需的,但也不妨礙宿主的生存。某些質粒攜帶的基因功能有利於宿主細胞的特定條件下生存,例如,細菌中許多天然的質粒帶有抗藥性基因,如編碼合成能分解破壞四環素、氯黴素、氨芐表黴素等的酶基因,這種質粒稱為抗藥性質粒,又稱R質粒,帶有R質粒的細菌就能在相應的抗生素存在生存繁殖。所以質粒對宿主不是寄生的,而是共生的。醫學上遇到許多細菌的抗藥性,常與R質粒在細菌間的傳播有關,F質粒就能促使這種傳遞。
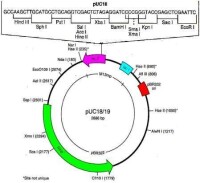
分子生物學使用的質粒載體都已不是原來細菌或細胞中天然存在的質粒,而是經過了許多的人工的改造。從不同的實驗目的出發,人們設計了各種不同的類型的質粒載體,近年來發展很快,新的有特定用途的質粒不斷被創建。圖1給出最常用的大腸桿菌克隆用質粒pUC19的圖譜,此質粒的複製起點處序列經過改造,能高頻率起動質粒複製,使一個細菌pUC19的拷貝數可達500-700個;質粒攜帶一個抗氨芐青霉素基因,編碼能水解β-內醯胺環,從而被壞氨芐青霉素的酶,當用pUC19轉化細菌後放入含氨芐青霉素的培養基中,凡不含pUC19者都不能生長,結果長出的細菌就是都含有pUC19的;pUC19還攜帶細菌lac操縱元中的lacI和lacZ基因編碼,β-半乳糖苷酶N端狀146個氨基酸的段落,當培養基中含有誘導物IPTG(isopropyl-thiogalactoside異丙基-硫代半乳糖苷)和Xgal(5-bromo-4- chloro-3-indolyl-β-D-galactopyranoside)時,lacZ ' 基因被誘導表達產生的β-半乳糖苷酶N端肽與宿主菌表達的C端肽互補而具有β-半乳糖苷酶活性(質粒和宿主編碼的肽段各自都沒有酶活性,兩都融為一體而具酶活性,稱為α-互補,α-complementation),半乳糖苷酶水解Xgal而使菌落呈現藍色;在lacZ '中間又插入了一段人工設計合成的DNA序列,其中密集多個常用的限制性核酸內切酶的位點,使外來的基因和序列能很方便地被插入此位置,當外來序列插入后則破壞了lacZ '編碼的半乳糖苷酶活性,生長的菌落就呈白色,這種顏色標誌的變化就很容易區分和挑選含有和不含有插入序列或基因的轉化菌落,稱為藍白篩選法。
除常用的大腸桿菌質粒載體外,近年來發展了許多人工構建的其它能用於微生物、酵母、植物等的質粒載體。含有不止一個ori、能攜帶插入序列在不同種類宿主細胞中繁殖的載體稱為穿梭載體(shuttle vectors)。
噬菌體(phage)是感染細菌的一類病毒,有的噬菌體基因組較大,加入λ噬菌和T噬菌體等;有的則較小,如M13、f1、fd噬菌體等。用感染大腸桿菌的λ噬菌體改造成的載體應用最為廣泛。
λ噬菌體由頭和尾構成,其基因組是長約49kb的線性雙鏈DNA分子,組裝在頭部蛋白質外殼內部,其序列已被全部測出。λ噬菌體感染時,通過尾管將基因組DNA注入大腸桿菌,而將其蛋白質外殼留在菌外。DNA進入大腸桿菌后以其兩端12bp的互補單鏈粘末端環化成環狀雙鏈,可以兩種不同的方式繁殖(圖2):①溶菌性方式(lytic pathway):在營養充足,條件適合細菌繁殖時,利用宿主菌中的酶類和原料,λDNA上基因可按調控的順序表達合成構成噬菌體頭、尾和尾絲所需的各種蛋白質,λDNA經多次複製合成許多子代λDNA,於是裝配成許多子代的λ噬菌體,最後裂菌,釋放出許多新的λ噬菌體。②溶原性方式(lysogenic pathway):進入細菌的λDNA可整合(integrate)入細菌的染色質DNA中,隨細菌染色體DNA複製,傳給細菌後代,這個穩定潛伏在細菌染色質DNA中的λDNA稱為原噬菌體(prophage),含有原噬菌體的細菌稱為溶源菌(lysogen)。λDNA的整合是可逆的,原噬菌體可從宿主DNA中切出,進入溶菌性方式的繁殖。
λ噬菌體整個基因組如圖3所示,可分為三個部分,①左臂:從A到J長約20kb,其中的基因編碼構成頭部、尾部、尾絲對組裝完整噬菌體所需要的蛋白質。②中段:長約20kb,是λDNA整合和切出,溶原生長所需的序列。③右臂:長約10kb,是調控區,控制溶菌和溶原生長最重要的調控基因和序列、以及λDNA複製起始均在這區域內。左右臂包含λDNA複製、噬菌體結構蛋白合成、組裝成熟噬菌體、溶菌生長所需全部序列;對溶菌生長來說,中段是非必需的。
利用λ噬菌體作載體,主要是將外來目的DNA替代或插入中段序列,使其隨左右臂一起包裝成噬菌體,去感染大腸桿菌,並隨噬菌體的溶菌繁殖而繁殖。廣泛使用的λ噬菌體載體也是已作過許多人工改造的,主要的改造是:①設計去除λDNA上的一些限制性酶切點。這是因為λDNA較大,序列中的限制性酶切點過多,妨礙其應用。②在中段非必需區,替換插入某些標誌基因如上述的可供藍白篩選lacI-lacZ’序列,和多克隆位點等。由此可構建出兩類λ噬菌體作載體;一類是插入型載體,可將外來序列插中段,常用的λgt系列載體,一般容許插入5-7kb外來DNA;另一類是轉換型載體,即可用外來DNA替代中段,如IMBL系列載體。
插入或置換中段外來的DNA長度是有一定限制的,當噬菌體DNA長度大於野生型λ噬菌體基因組105%或小於78%時,包裝而成的噬菌體存活力顯著下降。所以λ噬菌體載體可插入長5-20kb的外來DNA,這比質粒載體能插入的DNA長得多;而且包裝的λ噬菌體感染大腸桿菌要比質粒轉化細菌的效率高得多,所以λ噬菌體載體常用於構建cDNA文庫或基因組文庫。但λ噬菌體載體的克隆操作要比質粒載體複雜。
如果將左右臂和中段都去除,僅留下λDNA而端包裝噬菌體所必需的cos序列,再加上質粒的複製序列、標誌基因、多克隆位點等,就可構成cos質粒或稱為粘粒的載體。粘粒可插入45kb長的外源DNA,然後用λ噬菌體外殼蛋白包裝成噬菌體,感染大腸桿菌后,粘粒的DNA能以質粒的形式在細菌中繁殖而被克隆。所以粘粒主要用於DNA文庫的構建。
質粒和噬菌體載體只能在細菌中繁殖,不能滿足真核DNA重組需要。感染動物的病毒可改造用作動物細胞的載體。由於動物細胞的培養和操作較複雜、花費也較多,因而病毒載體構建時一般都把細菌質粒複製起始序列放置其中。使載體及其攜帶的外來序列能方便地在細菌中繁殖和克隆,然後再引入真核細胞。病毒載體常用者有改造來自猴腎病毒SV40(Simian Virus 40)、逆轉錄病毒和昆蟲桿狀病毒等,使用這些病毒載體的目的多為將目的基因或序列放入動物細胞中表達或試驗其功能、或作基因治療等(見后)。
人基因組十分龐大,約含4×109bp,建立和篩選人的基因組文庫,要求有容量更大的載體,酵母人工染色體(yeast artificial chromosome,YAC)載體應運而生。YAC含有酵母染色體端粒(telesome)、著絲點(centromere)及複製起點等功能序列,可插入長度達200-500kb的外源DNA,導入酵母細胞可以隨細胞分裂周期複製繁殖供作克隆,成為人基因組研究計劃的重要