共找到2條詞條名為瘦素的結果 展開
- 由脂肪組織分泌的蛋白質類激素
- Leptin
瘦素
由脂肪組織分泌的蛋白質類激素
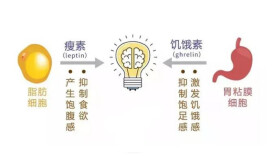
瘦素(Leptin)是一種由脂肪組織分泌的激素,它在血清中的含量與動物脂肪組織大小成正比。瘦素作用於位於中樞神經系統的受體(Leptin Receptor)從而調控生物的行為以及新陳代謝。當動物體的體脂減少或處於低能量的狀態下(例如飢餓),血清中瘦素的含量會明顯下降,從而激發動物的覓食行為,同時降低自身能量消耗。反之,當生物體的體脂增加時,血清中瘦素含量升高,進而抑制進食並且加速新陳代謝。瘦素就是通過這樣的負反饋機制來調控生物體的能量平衡以及體重。
主要由白色脂肪組織產生。其前體由167個氨基酸殘基組成,N末端有21個氨基酸殘基信號肽,該前體的信號肽在血液中被切掉而成為146氨基酸,分子量徠為16KD,形成Leptin。Leptin具有廣泛的生物學效應,其中較重要的是作用於下丘腦的代謝調節中樞,發揮抑制食慾,減少能量攝取,增加能量消耗,抑制脂肪合成的作用。研究表明編碼基因ob,缺失ob基因的大鼠,食慾旺盛,體重顯著增加,導致病態肥胖。它在身體的濃度使腦部知道現時身體上的脂肪數量,藉以控制食慾及新陳代謝的速率。
瘦素透過抑制體內神經肽Y neuropeptide Y (NPY)刺鼠肽基因相關蛋白agouti-related peptide (AgRP)的活躍程度,從而使體內另一種荷爾蒙黑色素細胞刺激激素alpha-melanocortin stimulating hormone (α-MSH)的活躍情度增強。
隨著2000年以來對瘦素探討的不斷深入,人們開始認識到瘦素不僅由脂肪組織分泌,其它組織如乳腺上皮細胞、胎盤、胃黏膜上皮細胞也中可檢測到,其受體不僅存在於丘腦、脂肪組織,還廣泛存在於全身各個組織。瘦素與機體系統的病理生理關係正逐步被人們了解。
瘦素與肥胖
來自美國的科學家道格拉斯·高爾曼和傑弗理·弗理德曼在20世紀60至80年代,先後致力有關方面的研究,最後成功揭開這一科學謎底,二人亦因此成為東方諾貝爾之稱的邵逸夫獎生命科學與醫學獎得獎者,共獲得100萬美元獎金。
早在20世紀60年代,當時於美國緬因州傑克遜實驗室工作的高爾曼,在參與關於糖尿病和體重問題的老鼠實驗后,提出體重是與生物本身基因有密切關聯的科學猜想。他在受訪時憶述,隨後即開始了關於2種因基因突變而出現嚴重肥胖的老鼠的研究,結果成功發現,部分老鼠因無法產生某種抑制食慾的激素而致肥,另一部分則製造過量相關激素,但因身體缺乏接收有關激素訊息的受體,令其出現肥胖問題。
高爾曼設立的體重與激素及基因之間的假設,在80年代被於紐約洛克菲勒大學工作的弗理德曼重拾,他在長達10年的試驗中,終於定位了一種導致老鼠體重問題的基因,並將其命名為“瘦素”;他證實了某些人的確是在激素信號傳遞失衡的情況下產生肥胖,甚至因此胰島素失衡帶來糖尿病。這項“接力式”的合作科學成果為肥胖問題研究帶來革命性的改變,而弗理德曼亦將繼續嘗試從中尋找可完全治療肥胖的有效方式。道格拉斯·高爾曼發現,極少數人食量驚人,因為他們在體內存在著瘦素基因突變,產生的瘦素太少,這種病人在接受瘦素替代療法以後體重迅速下降,所以瘦素的發現讓人們對肥胖症的理解和認識有了飛躍,又向著擺脫肥胖邁進了一步。由於瘦素對於治療肥胖症有著非常好的療效,堪稱“減肥素”。預計在不久的將來以瘦素為主要成分的減肥藥,也很有可能會出現在生活當中,從而在很大程度上改變普通人的生活。
瘦素基因(ob)在1994年由洛克菲勒大學的Friedman教授團隊率先克隆。這個重大發現讓學界認識到肥胖和基因的密切聯繫,從而也開啟了科學家們對於肥胖、能量代謝以及神經內分泌學研究的新篇章。由於瘦素基因突變導致缺失瘦素的小鼠異常肥胖(ob/ob),這是因為瘦素受體接受不到信號,導致該突變小鼠長期處於虛假的“零脂肪低能量狀態”。這種小鼠會表現出極強的食慾,同時由於自身能量代謝和脂肪的分解被抑制,最終積累出超過正常小鼠數倍的脂肪。進一步研究揭示,通過對該突變小鼠進行長期瘦素蛋白治療,其食慾以及新陳代謝會回歸正常,其肥胖癥狀也會最終消失。在過去的二十多年裡,儘管人們對瘦素與小鼠食慾和新陳代謝調控的關係已經有了相當程度的認識,但是對瘦素如何促進脂肪分解和利用的具體機制仍不清楚。
1999年11月,一位學者披露了他的研究結果,說是用瘦素治療肥胖症,可以加快體重下降速度,而使用大劑量瘦素則可使身體脂肪減少更多。在對123名肥胖者進行的4周試驗表明:使用0.01毫克瘦素者,體重下降了0.7公斤;使用0.10毫克者,下降了2.4公斤;使用0.30毫克者,則平均下降7公斤。
瘦素的功能是多方面的,主要表現在對脂肪及體重的調控:
1、抑制食慾:瘦素可使人類進食明顯減少,體重和體脂含量下降。
2、增加能量消耗:瘦素可作用於中樞,增加交感神經活性,使大量貯存的能量轉變成熱能釋放。
3、對脂肪合成的影響:瘦素可直接抑制脂肪合成,促進其分解,也有人認為可促進脂肪細胞成熟。
4、對內分泌的影響:胰島素可促進瘦素的分泌,反過來瘦素對胰島素的合成、分泌發揮負反饋調節。

瘦素
瘦素抵抗的出現是直接由循環中瘦素水平上升而引起的。作一個非常恰當的比喻,瘦素抵抗在肥胖症中的地位類似於胰島素抵抗在2型糖尿病中的角色。生理水平的瘦素可引起血管舒張,對心肌功能無明顯影響,而病理水平的瘦素可促進大量氧化自由基的產生,進而產生明顯的負性心肌肌力作用。有證據表明,病理水平的瘦素引起的負性心肌肌力作用可能是通過內皮素受體(ET-1Receptor)及其下游的還原型輔酶Ⅱ(NAPDH)氧化酶的激活來實現的。NAPDH氧化酶的激活直接產生大量超氧陰離子。這些結果在瘦素過剩的db/db小鼠模型中已獲得證實。
造成生理水平瘦素對心臟功能的調節缺失,導致心肌肥大、心功能低下與瘦素水平上調相反,瘦素水平的下降也可直接促使瘦素信號傳導的缺失,從而造成生理水平瘦素對心臟功能的調節缺失。筆者的實驗室對遺傳性瘦素缺乏的ob/ob肥胖鼠進行了深入的研究。結果表明,瘦素水平的低下導致小鼠明顯肥胖(其體重是野生型鼠的兩倍),心臟肥大,心肌收縮力下降,收縮/舒張速率減慢,舒張時間延長,心肌細胞鈣調節紊亂等多種心功能低下。有趣的是,補充瘦素能夠顯著改善由於瘦素缺乏造成的心肌肥大和心功能低下,同時對體重的增加有顯著的抑制作用。
進一步研究結果表明,瘦素水平的低下直接引起了胰島素敏感性的下降。筆者所在的實驗室在2007年對胰島素增敏劑鉻複合物進行了結構改變,得到了一種新的鉻氨基酸複合物(已取得美國專利),我們用該複合物對ob/ob瘦素缺乏的肥胖鼠進行了胰島素增敏治療。經過6個月的口服給葯[45μg/(kg/d)],ob/ob小鼠的心肌功能獲得明顯改善,心肌細胞內鈣調節紊亂得以糾正,而這些心肌功能指標的改善是與心肌胰島素敏感性的改善相吻合的。由此看來,無論是瘦素水平上升或缺失,均可導致瘦素對機體能量及脂肪代謝調節的紊亂,從而促成肥胖症以及最終2型糖尿病的發生。而高脂飲食或營養過剩均可導致瘦素水平急劇上升,以及由此引起的瘦素抵抗,使瘦素不能正常地完成對脂肪、能量代謝的促進及與此相關的食慾抑制作用。
瘦素在體內對人體的體重調節是雙向的,通常稱做體脂的自穩系統。可理解為:當人體能量攝入正平衡時,體脂增加,促使脂肪細胞瘦素分泌增多,瘦素作用於下丘腦,結合其受體,產生飽食反應,從而降低食慾,減少能量攝取,促進能量消耗;當人體體重降低時,脂肪組織瘦素分泌下降,作用於下丘腦的另一受體,產生飢餓反應,增加食慾,提高攝食量,降低能耗。照這樣說,人體體重應該保持在正常範圍內,為何會出現肥胖者越來越多的現象呢?這就是瘦素抵抗問題。瘦素雖然分泌很多,但是發揮不了作用。大多數肥胖者血清瘦素水平比非肥胖者高;只有不到5%的肥胖者,其瘦素是缺乏的。最為遺憾的是,肥胖者不但出現體內瘦素的抵抗反應,並且對外源性的瘦素也同樣存在抵抗性。因此,應用瘦素治療肥胖,目前還處於實驗階段。
2020年7月22日,洛克菲勒大學Friedman教授團隊(共同一作為王浦天琦和Ken H. Loh)在Nature雜誌上發表文章“A Leptin-BDNF pathway regulating adipose innervation”,揭示了瘦素如何調控交感神經在脂肪組織內的分佈,同時闡述了該交感神經對於脂肪分解與運用的重要作用。