人造血液
人造血液
人造血液,又稱氟化碳乳劑人工血液,英文名Artificial blood;人造血液是一類具有載氧能力,可暫時替代血液部分功能的液體製劑。主要用於外傷、醫療手術等所致大出血的治療,近年來開始用於遺體器官的保存、一氧化碳中毒的治療,以及體外循環預充液和心肌保護的研究。
2013年羅馬尼亞科學家研製出一種人造血液—由水、無機鹽以及一種深海昆蟲體內提取的蚯蚓血紅蛋白合成的材料,可短時間替代血液實現氧氣和二氧化碳交換代謝。同年12月,日本研究人員成功利用幹細胞培育出能夠攜帶氧的紅細胞,在此基礎上可以大量培育用於輸血的紅細胞,幫助醫療系統緩解用血緊張狀況。
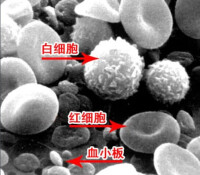
血液
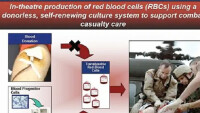
血液嫁接
1979年,一種新型的氟碳化合物乳劑作為人造血液,首次在日本應用於人體單腎臟移植手術,並取得成功。時隔不久,美國也報道了人造血液給一位信仰宗教、拒絕輸血的老人治療血液病獲得成功。這種奇妙的人造血液,是白色的;不分血型,不管哪種血型的人都能使用,所以我們說人造血液是名符其實的萬能血液。
1980年8月6日,中國人造血液的研究在上海獲得成功。這是中國科學院上海有機化學研究所和中國人民解放軍第三軍醫大學的科學工作者經過5年的研究而試製成功的。人造血液是氟碳化合物在水中的超細乳狀液。這種奇妙的白色血液注入人體后,同人體正常血中的紅細胞一樣,具有良好的載氧能力和排出二氧化碳的能力,可以說,它是一種紅細胞的代用品。氟碳化合物像螃蟹的螯那樣,能夠把氧抓住,在人體里再把氧氣放出來,進行人體里的特種氧化還原反應。它的生物化學性質十分穩定,不管哪種血型的人,都能使用人造血液。
中國人造血液研製成果
當歐洲研究員還把目光聚焦在以血紅蛋白為基礎的產品上時,美國已經轉向了另一人造血液來源———一種被稱作六氟化硫的聚四氟乙烯類型的人工合成液體上。六氟化硫可消溶大量氧氣,造價便宜,易於製作,並且儲藏簡單。但在操作過程中,病人需要通過特定面具吸入70%-100%的氧氣,這就意味著在醫院以外的環境下使用這種物質的可能受到限制。
英國研製人造血液
2013年,羅馬尼亞科學家研製出一種人造血液—由水、無機鹽以及一種深海昆蟲體內提取的蚯蚓血紅蛋白合成的材料,可短時間替代血液實現氧氣和二氧化碳交換代謝。這一成果如果得以成功推廣應用,則有望緩解血庫的供給短缺,甚至避免血液污染的風險,同時通過化學修飾,實現對氣體的高溶解度,避免氣泡的產生,大大提高輸血的適用範圍和臨床功效。
2013年12月,日本研究人員成功利用幹細胞培育出能夠攜帶氧的紅細胞,在此基礎上有望大量培育用於輸血的紅細胞,幫助醫療系統緩解用血緊張狀況。
研究發現雖然成熟的紅細胞不能自我複製,但其發育過程中的“半成品”——紅系祖細胞具有複製能力,他們發現有兩個基因對紅系祖細胞的複製和成熟發揮重要作用。將這兩個基因導入誘導性多能幹細胞和胚胎幹細胞中后,成功培育出在實驗室中幾乎可以無限複製增殖的紅系祖細胞,並使它們成功分化為成熟的紅細胞。分化出的紅細胞中大部分都是胚胎血紅蛋白,與成人血紅蛋白不同,但研究人員證實這些血紅蛋白有攜氧能力,並能在輸血后在實驗鼠體內循環。
人造血液主要有三種:
(1)人工合成的血紅蛋白;
(2)用天然血紅蛋白製成的人工紅血球;
(3)人工合成具有攜氧功能的氟碳化合物。氟碳代血液是由全氟化合物組成的膠體超微乳劑,具有良好的攜氧能力,在一定濃度和氧分壓條件下,其氧溶解度為水的20倍,比血液高2倍。作為人工血應用較好的氟碳化合物有全氟正丁基呋喃、全氟三丁胺、氟列昂E4、全氟萘烷、全氟甲基萘烷,全氟三丙胺等。
人們發現了兩大類血液替代品——血紅蛋白攜氧載體(HBC)和全氟碳化物(PFC)。已經有部分人工血液接近測試階段的尾聲,很快便可在醫院應用。另有一些則已經開始應用。例如,被稱為牛血紅蛋白多聚體(Hemopure)的HBOC類血液替代品正應用於受HIV威脅嚴重的南非。而在歐美,一種名為Oxygent的PFC類攜氧載體已進入人體試驗的後期階段。
這兩類血液替代品化學結構迥異,但基本都是通過被動擴散來實現功能。被動擴散利用了氣體趨向於從高濃度區域移至低濃度區域,直至達到平衡狀態的屬性。在人體內,氧氣從肺(高濃度)移至血液(低濃度)中;隨後,一旦血液到達毛細血管,氧氣即從血液(高濃度)移至組織(低濃度)。
HBOC與血液大致類似。它們呈暗紅色或紫紅色,由經滅菌處理的血紅蛋白製成,血紅蛋白的來源有很多:
1、來自過期的人類血液的紅細胞
2、來自牛血的紅細胞
3、可產生血紅蛋白的轉基因細菌
4、人類胎盤
但是,醫生不能直接將血紅蛋白注射到人體中。當血紅蛋白進入血細胞后,完全可以起到攜帶和釋放氧氣的功能。但如果沒有細胞膜的保護,血紅蛋白的分解速度會非常快,可能會導致腎臟嚴重損傷。
出於該原因,大多數HBC使用的是比天然分子堅固得多的改進型血紅蛋白。一些最常見的技術是:
1、將血紅蛋白分子與名為雙阿司匹林的攜氧血紅蛋白衍生物進行部分交聯
2、過多分子彼此結合,形成聚合血紅蛋白
3、將其與聚合物結合,形成共軛血紅蛋白
科學家還研究了由類脂物、膽固醇或脂肪酸製成的人造膜包裹血紅蛋白的HBOC。有一種名叫MP4的HBOC就是由聚乙二醇包覆的血紅蛋白製成的。
HBOC的工作方式與普通紅細胞大致相同。HBOC分子漂浮在血漿中,從肺中獲得氧氣並將其釋放到毛細血管中。這些分子比紅細胞小得多,因此可以到達紅細胞無法流經的地方,如極端腫脹的組織或惡性腫瘤周圍的異常血管等。大多數HBOC在人體血液中停留一天左右——比普通紅細胞100天的循環周期短得多。
但是,HBOC也有一些副作用。改進型血紅蛋白分子可進入細胞間的微小空間並結合一氧化氮,一氧化氮對於維持血壓非常重要。這會導致病人的血壓飆升。HBOC還可導致腹部不適和絞痛,這很可能是由於自由基的釋放,而自由基是一種對細胞有害的分子。某些HBOC還會導致眼睛暫時變紅或皮膚潮紅。
與HBOC不同,PFC通常是白色的,完全由人工合成。它們與碳氫化合物很相似,但它們包含的是氟而不是氫。
PFC具有化學惰性,但在攜帶溶解氣體方面很出色。它們能夠比水或血漿多攜帶20%至30%的氣體,如果存在更多的氣體,它們還能攜帶得更多。出於該原因,
醫生在使用PFC的同時會進行輸氧。但是,多餘的氧氣可導致人體內自由基的釋放。研究人員正在研究PFC能否在沒有額外氧氣的條件下工作。
PFC既油又滑,因此在使用時必須先進行乳化處理或懸浮在某種溶液中。PFC一般與通常用於靜脈注射的其他藥物混合使用,如卵磷脂或白蛋白。這些乳化劑最終會在離開血液循環系統時分解,肝臟和腎臟將其從血液中除去,肺會像呼出二氧化碳一樣,將PFC呼出體外。有時,在機體分解和呼出PFC時,人體會產生類似流感的癥狀。
與HBOC類似,PFC體積很小,可以到達紅細胞無法到達的地方。出於該原因,有些醫院研究了是否可以使用PFC將氧氣送過腫脹的腦組織,以此治療創傷性腦損傷(TBI)。
製藥公司正在測試PFC和HBOC在某些特定醫療情況下的療效,但它們還有很多潛在用途,例如:
1、在創傷失血后,恢復人體供氧能力,特別是在急救室和戰場上
2、預防在手術過程中突然急需輸血
3、維持通向腫瘤組織的氧流量,以使化療更為有效
4、治療會導致紅細胞數量減少的貧血病
5、向受到鐮刀狀細胞貧血症影響的身體腫脹組織輸送氧氣
一種是利用乳化了的全氟碳製劑,即全氟碳乳劑,通過溶解氧的方式來完成血氧代謝。這種化學製劑結構簡單,運用方便,且有很高的溶解氧能力,可以實現更大範圍的醫療輔助。
另一種思路是模擬人體血液中血紅蛋白的攜氧機制,羅馬尼亞科學家拉杜教授設計出的人造血液採用的便是這種設計思路。這類人造血液有著較好的生理相容性,輸血后產生的排異反應和免疫反應較小。以往的人造血液由於缺少自然血液中所必需的生化組分,其血氧解離曲線(一種描述攜氧能力的關係圖)與正常生理情況不一致。
人造血紅蛋白在無細胞的環境下,化學性質很不穩定,對血液滲透壓影響也較大,且有一定的腎毒性,而拉杜教授的最新研究成果,既可以很好地模擬生理環境下的血液攜氧機制,又能保持一定的化學穩定性,從而降低了腎毒性和對血壓的擾動。這種人造血液的最新動物全血置換實驗已取得了較好的結果,有望用於臨床試驗。
碳氟化物
碳氟化物(PFC)的化學結構類似鐵氟龍(聚四氟乙烯),主要是由碳原子與氟原子所組成。在我們日常生活中,炒菜鍋的內面常鍍上一層鐵氟龍,主要是因為鐵氟龍化性相當穩定,且由於它的表面能很低,可以防止煎魚或煎蛋時易沾鍋的現象。碳氟化物不但化學性質穩定,在生物體內也相當安定,在做成人工替代血液的過程中以及高溫滅菌與後續的產品保存期間也都相當穩定。
對於氧氣來說,碳氟化物是一個相當好的溶劑,可以自肺里攜帶氧氣至人體內的各部分組織與器官,讓細胞進行新陳代謝。在執行完它的輸氧功能之後,碳氟化物又可經由呼吸作用自肺排出,或經由排汗的過程由皮膚表面排出。
假如我們將一隻老鼠放在盛有碳氟化物溶液的燒杯里,老鼠並不會如我們被淹死,主要的原因是可以溶解大量的氧氣。由於碳氟化物不溶於水,所以通常是以乳化的方法將其製成大約200納米大小的顆粒分散液,再以點滴的方式注入病人的靜脈里。與人體紅血球的尺寸(1~8微米)相比,經乳化后的碳氟化物納米顆粒相當小,其攜帶氧氣的面積可以大幅提高,且可以穿過紅血球無法通過的阻塞血管,達到實時救命的目的。碳氟化物仍在臨床試驗的階段。
經化學修飾的血紅素
血紅素的分子量約為64,50dalton,主要存在於紅血球中,由四個胜肽鏈所組成,分別為二個α鏈與二個β鏈,每一個α鏈由14個氨基酸所組成,而β鏈則為146個氨基酸所組成。每條α鏈及β鏈上皆有一個原血紅素基與之相連,其中的亞鐵離子(Fe2+)可以利用配位鍵的方式與一個氧分子結合,能夠可逆地行使攜氧與釋氧的功能,因此每一個血紅素分子最多可以攜帶四個氧分子。
在人體內,當紅血球行經肺臟時,由於肺泡里的氧分壓高達100毫米汞柱(mmHg),使得紅血球里的每一血紅素分子可以充分地攜帶氧氣。當攜氧的紅血球行經人體的各部分組織或器官時,由於氧分壓降至約40毫米汞柱,紅血球里的血紅素分子便將其所攜帶的氧分子釋放出來,以參與附近細胞的新陳代謝作用。血紅素與氧分子的親和力,與紅血球內的一重要分子(2,3-DPG)有相當密切的關係。
經由純化過程所取得的血紅素溶液,由於紅血球被打破,造成2,3-DPG分子的流失,導致血紅素對氧的親和力過高,而降低了其在人體組織或器官中的釋氧功能。因此若以血紅素為基質來製備人工替代血液,必須對純化出來的血紅素溶液做適當的物理或化學修飾,以符合人體的生理要求。當前以血紅素為基材發展的人工替代血液,大致可分為包覆型人工替代血液、基因重組型人工替代血液與聚合型人工替代血液等。
a,包覆型人工替代血液:以磷脂質經由乳化技術將血紅素包覆起來,形成直徑約100~200奈米大小的顆粒,如此可以避免血紅素在體內被快速分解掉,增加其在人體血液循環中的半衰期,且在人體膠體滲透壓的限制下,可以有正常的血紅素濃度。在包覆過程中同時也把2,3-DPG分子包覆在磷脂質裡面,以調控血紅素分子對氧分子的親和力。
b,基因重組型人工替代血液:主要是利用基因技術,將血紅素的α或β鏈的基因轉殖到大腸桿菌裡面,由大腸桿菌來表現,製造出血紅素分子。利用基因技術可以改變α或β鏈上某些特定的氨基酸,例如將β鏈上第108個氨基酸,由原來的天門冬胺酸改變成離胺酸,可以使得血紅素對氧的親和力降低。
c,聚合型人工替代血液:又可分為分子內部交聯型血紅素、分子與分子間交聯型血紅素與共軛交聯型血紅素。
1.分子內部交聯型血紅素:血紅素分子內部的交聯可以用PLP(pyridoxyl 5'-phosphate)分子代替2,3-DPG分子,做為修飾血紅素對氧分子親和力的交聯劑。由於PLP和2,3-DPG對脫氧狀態的血紅素分子結合的位置相同,因此可以穩定其去氧結構,使血紅素對氧的親和力降低。這樣的分子內部交聯也同時穩定了血紅素的四聚體結構,避免在人體血液循環過程中被快速分解掉,因此可以改善血紅素分子在人體內滯留的半衰期。
2.分子與分子間交聯型血紅素:分子內部交聯后的血紅素分子,若進一步以另一交聯劑將血紅素分子與分子間交聯起來,則可以有效地增加其在人體血液循環中的半衰期達六至七倍。較常用的交聯劑為戊二醛。
聚合血紅素最重要的就是控制其分子量分佈及適當的攜氧能力,較適當的分子量大小約在20萬~40萬dalton,以不超過50萬dalton為佳,也就是相當於二至八個血紅素分子聚合的大小。若聚合程度過高,則聚合后的血紅素溶液黏度會過大,導致血液流變性質的改變。若血紅素分子聚合程度過低,則無法得到適當的攜氧能力以及在人體內的適當半衰期。
然而戊二醛與血紅素分子進行的聚合反應很快,所製造出來的聚合血紅素分子量分佈往往相當廣,容易造成許多過聚合的高分子聚合物。此外,戊二醛聚合血紅素無法在儲存及加熱過程中維持穩定結構,容易釋放出對人體有害的戊二醛分子,因此戊二醛並非製造聚合血紅素最佳的交聯劑。
3.共軛交聯型血紅素:利用交聯劑將血紅素分子以共價鍵結的方式鍵結在水溶性高分子鏈上,目的除了增加血紅素分子的體積以減緩血紅素分子由腎絲球體漏出外,亦可避免血液中其它蛋白質的吸附,以降低人體免疫系統的攻擊。
2010年10月,33歲的澳大利亞婦女塔馬拉·科克利發生嚴重車禍,頭骨、肋骨、肘部多處骨折,心肺功能衰竭,脾臟破裂,失血過多,生命垂危。在被送往墨爾本的阿爾弗雷德醫院后,醫護人員發現科克利是一名“耶和華見證人”的信仰者,這一信仰使得她不能接受輸血。當時醫生斷定,科克利活不過24小時。就在這時,該院外傷醫生馬克·菲茨傑拉德忽然想到使用血液替代品——HBOC-2-1(血紅蛋白氧載體),這是一種利用牛的血漿人工合成的血液替代品,由美國軍方研製而成的。菲茨傑拉德醫生說:“我們想到使用血液替代品,但只有美國才有,而且只有10個單位。在取得聯繫后,美國方面把10個單位的產品都給了我們。”在輸入了替代血液后,科克利的血紅蛋白逐漸上升,她漸漸蘇醒,如今已經恢復了健康。菲茨傑拉德醫生曾參與了美國的人工合成血液研製,因此對這種產品非常熟悉。採用人工合成血液救治患者,對於世界性的血液短缺有重要啟示,這種替代血液不需要血型的匹配,不需要冷藏,在常溫狀態下可以保持3年之久,對於缺乏足夠血源的偏遠地區而言,這可能是挽救失血患者生命的最佳選擇。
世界各地的醫院每年需要大量血液,但全世界每年捐獻的血液遠遠無法滿足這一需求。而經過研究試驗表明,“人造血”具有高氣溶性,在血管內可起到攜帶氧氣和排除二氧化碳的作用。它有以下幾個特點:
一是不受血型限制,可用於各種血型的人,輸血后不會發生嚴重的溶血反應,特別是在搶救情況下,時間就是生命,可以不查血型,不做交叉配血試驗而馬上使用,對大規模的現場急救,更是簡便、快速;
二是容易保存,不必像獻血者的鮮血那樣要貯存在4℃一6℃的冰箱內,人造血可保存數年之久;
三是不會發生交叉感染。通常輸血如果檢查不嚴,會將一些細菌、病毒帶入受血者體內,發生交叉感染,而人造血液是工業生產製造的,不會有細菌或病毒的混入。
人造血液與人體內的血液相比,還有許多缺點,它不能輸送養分,也沒有凝固血液的本領,更沒有對外界感染至關重要的免疫能力。因此要研究出像人的血液那樣的代用品,還要經過很大的努力。
有些產品已處在臨床試驗的最後階段,但在人類身上進行試驗時,有些病人出現像流感一樣的徵狀。不像真的紅色原料,血紅蛋白和六氟化硫都只能在血流條件下,在幾天內起作用,因此它們只在短期內有幫助。然而,它們確實在減少傳染病的傳播途徑和為拒絕輸血的宗教徒提供新的選擇方面有很大潛力。
“我們都盼望有朝一日用上可以長時間冷凍、儲存的人造血,這應該是未來發展的大方向。”復旦大學附屬華山醫院血液科的陳勤奮醫生說。
陳勤奮認為,一旦相關技術成熟,人造血可以通過標準的流水線生產。對若干年後的病人來說,可能輸一次血就跟吃一粒葯一樣稀鬆平常——因為都是流水線加工的標準產品。
不過也有倫理學界對此持更謹慎態度。從人工DNA到人工合成細胞再到人工製造血液,合成生物學屢屢有振聾發聵的新突破,但正如英國《觀察家報》的評價所言,“這是21世紀最為大膽、最有爭議、也最具科學性的領域”。據悉,英國皇家學會已經開始就合成生物技術向公眾徵集意見,考慮出台相關的監管條例。
此外,也有專家認為,合成生物學很可能會消解人類對於自然的最後一點敬畏之心。當身上流的血液都是人工造的,人們在感慨技術強大的同時,是不是再也不會對生命充滿感激和尊重?
