離子晶格
離子晶格
離子晶格(ionic crystal lattice)是晶體結構中質點間的結合以離子鍵占主導地位的晶格。組成離子晶格的質點是離子(包括絡離子),陽離子大多具有中等數值(6左右)的配位數。離子晶格晶體一般表現為透明或半透明,具非金屬光澤,硬度和熔點一般較高,是電的不良導體,但熔融或溶解后能導電。
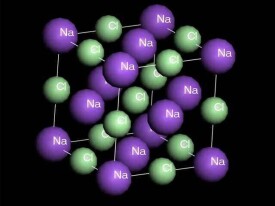
離子晶格其質點為離子,典型的離子晶體為氯化鈉(),氯離子()與鈉離子()。陰離子半徑遠遠大於陽離子半徑,所以可以認為緊密堆積的幾何形狀主要取決於陰離子的半徑。因此,在離子晶格中可以視為陰離子的最緊密堆積,陽離子可以看成是充填於空隙之中,陰陽離子間距則取決於兩者半徑之和,為了使格子構造具有最好的位能。
在這類晶格中,結構單位為得到和失去電子的陰、陽離子,它們之間靠靜電引力相互聯繫起來,從而形成離子鍵。它們的電子云一般不發生顯著變形而具有球形的對稱,即離子鍵不具有方向性和飽和性。因此,結構中離子間的相互配置方式,一方面取決於陰、陽離子的電價是否相等;另一方面取決於陽、陰離子的半徑比值。通常陰離子呈最緊密或近於最緊密堆積,陽離子充填於其中的空隙並具有較高的配位數。離子晶格中,由於電子都屬於一定的離子,質點間的電子密度很小,對光的吸收較少,易使光通過,從而導致晶體在物理性質上表現為低的折射率和反射率、透明或半透明、具非金屬光澤和不導電(但熔融或溶解后可以導電)等特徵。晶體的機械性能、硬度與熔點等則隨組成晶體的陰、陽離子電價的高低和半徑的大小有較寬的變化範圍。
離予晶格具有下列性質:
1.由於離子間沒有自由電子存在,故離子晶體為電的不良導體。但熔融后可形成自由移動的離子,因此熔體又具導電性。
3.由於離子晶格是由陰陽離子組成,而水分子( )為極性分子,所以離子晶格的礦物比金屬晶格和原子晶格的礦物在水中的溶解變要大得多。
自然界中絕大多數礦物為離子晶體。絕大多數含氧鹽,常見的氧化物、氫氧化物及鹵化物類矽物,均屬離子晶格類型。
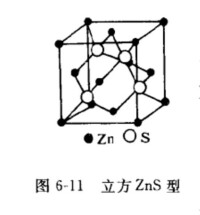
一般說來.獲得電子的負氧離子半徑比失去電子的陽離子大。故大的負氧離子基本上呈密排結構,佔領面心立方結構中的頂點和面心位置。如果半徑較小的金屬離子全部佔據八面體空隙,則氧離子與金屬離子數的比例為,即形成形式的氧化物。若金屬離予全部佔領四面體空隙,則氧離子數與金屬離子的比例為即形成形式的氧化物。
1.型結構
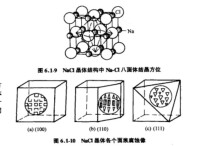
NaCl各個面俯視圖
離子晶格
離子晶格
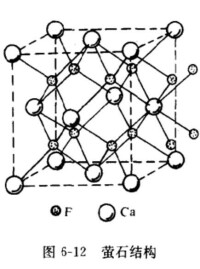
3.螢石型結構與逆螢石型結構如圖6—12所示。若金屬離子如 呈密排(緊密堆積)面心立方結構,而非金屬離子填滿其中的四面體空隙,則形成典型的螢石( )結構。