自噬
分解合成過程所須的中間代謝物的過程
自噬是一個吞噬自身細胞質蛋白或細胞器並使其包被進入囊泡,並與溶酶體融合形成自噬溶酶體,降解其所包裹的內容物的過程,藉此實現細胞本身的代謝需要和某些細胞器的徠更新。
自噬在機體的生理和病理過程中都能見到,其所起的作用是正面還是負面的尚未完全闡明,對腫瘤的研究尤其如此,值得關注。
自噬(autophagy)是由 Ashford 和 Porter 在 1962 年發現細胞內有“自己吃自己”的現象后提出的,是指從粗面內質網的無核糖體附著區脫落的雙層膜包裹部分胞質和細胞內需降解的細胞器、蛋白質等成分形成自噬體(autophagosome),並與溶酶體融合形成自噬溶酶體,降解其所包裹的內容物,以實現細胞本身的代謝需要和某些細胞器的更新。
(1)飢餓應答時的作用,在不同的器官如肝臟或在培養細胞中,氨基酸的匱乏會誘導細胞產生自體吞噬,由自體吞噬分解大分子,產生在分解代謝和合成代謝過程中所必須的中間代謝物。
(2)在細胞正常活動中的作用,如在動物的變態發育、老化和分化過程中,自體吞噬負責降解正常的蛋白以重新組建細胞。儘管通常人們認為自體吞噬不具有選擇性,但是在某些病理和壓力條件下,通過自體吞噬能選擇性地隔離某些細胞器,如線粒體、過氧化物酶體等。
(3)在某些組織中的特定功能,如黑質的塞梅林神經節中,多巴胺能神經元中的神經黑色素的合成就需要把細胞質中的多巴胺醌用AV包被隔離起來。
AUTOPHAGY
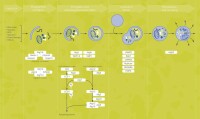
由於自體吞噬較少受到關注,而且很難在體外實驗條件下實現,因此到目前為止,對自體吞噬的機制還不是很了解。研究主要集中在酵母及其它重要的單細胞真核生物,而對植物和哺乳動物細胞中的自體吞噬過程的了解則更少。儘管對自體吞噬具體過程的了解還需要大大加強,但是人們已經勾勒出自體吞噬過程的大致輪廓:細胞質中的線粒體等細胞器首先被稱為“隔離膜”的囊泡所包被,這種“隔離膜”主要來自於內質網和高爾基體;囊泡最終形成雙層膜結構,即自吞噬體(autophagosome),也稱之為初始自體吞噬泡(initial autophagic vacuoles , AVi);自吞噬體與胞內體融合形成中間自體吞噬泡(intermediate autophagic vacuoles, AVi/d);最終自體吞噬泡的外膜與溶酶體融合形成降解自體吞噬泡(degrading autophagic vacuoles, AVd),由溶酶體內的酶降解自體吞噬泡中的內容物和內膜。在整個自體吞噬過程中,細胞質和細胞器都受到破壞,最明顯的是線粒體和內質網受損。雖然自體吞噬並不直接破壞細胞膜和細胞核,但是有證據表明,在最初斷裂或消化后,細胞膜和細胞核會最終變成溶酶體以消化和分解自身。
根據細胞物質運到溶酶體內的途徑不同,自噬分為以下幾種。
①大自噬:由內質網來源的膜包繞待降解物形成自噬體,然後與溶酶體融合併降解其內容物;
②小自噬:溶酶體的膜直接包裹長壽命蛋白等,並在溶酶體內降解;
③分子伴侶介導的自噬(CMA):胞質內蛋白結合到分子伴侶后被轉運到溶酶體腔中,然後被溶酶體酶消化。CMA 的底物是可溶的蛋白質分子,在清除蛋白質時有選擇性,而前兩者無明顯的選擇性。
自噬體(autophagy)
自噬溶酶體(autolysosome)
當自噬體與溶酶體融合后,形成自噬溶酶體。
自噬性溶酶體是一種自體吞噬泡, 作用底物是內源性的,即細胞內的蛻變、破損的某些細胞器或局部細胞質。這種溶酶體廣泛存在於正常的細胞內,在細胞內起“清道夫”作用,作為細胞內細胞器和其它結構自然減員和更新的正常途徑。在組織細胞受到各種理化因素傷害時,自噬性溶酶體大量增加,因此對細胞的損傷起一種保護作用。
自噬性溶酶體的作用底物是內源性的,即來自細胞內的衰老和崩解的細胞器或局部細胞質等。它們由單層膜包圍,內部常含有尚未分解的內質網、線粒體和高爾基複合體或脂類、糖原等。正常細胞中的自噬性溶酶體在消化、分解、自然更替一些細胞內的結構上起著重要作用。當細胞受到藥物作用、射線照射和機械損傷時,其數量明顯地增多。在病變的細胞中也常可見到自噬性溶酶體。
溶酶體的作用還包括對細胞內物質的消化,溶酶體能消化分解經胞吞作用攝入細胞內的各種物質和細胞內衰亡或損傷的各種細胞器等。
吞噬性溶酶體內的各種大分子在水解酶的作用下,可被分解為簡單物質。例如,能將蛋白質分解為二肽或遊離氨基酸;把核酸分解為核苷和磷酸;使碳水化合物分解為寡糖類或單糖;將中性脂肪分解為甘油和脂肪酸等。這些被分解而生成的可溶性小分子物質,能透過溶酶體體膜進入細胞質基質,重新參與細胞的物質代謝,一些未被完全消化的物質殘留下來,形成殘餘小體。
在骨生長和骨重建過程中,溶酶體對骨質的更新起著重要作用。破骨細胞的溶酶體酶能釋放到細胞外,分解和消除陳舊的骨基質,這是骨質更新的一個重要步驟。溶酶體酶釋放的具體過程可能是:細胞內的環化酶活性發生改變后,隨著cAMP的增加,蛋白質激酶被活化而引起微管及其周圍的蛋白質的磷酸化,其結果微管發生聚集,致使溶酶體向細胞膜方向移動,並與細胞膜相互融合,然後溶酶體內的水解酶被排出細胞外,以分解和消除陳舊的骨質。
正常培養的細胞自噬活性很低,不適於觀察,因此,必須對自噬進行人工干預和調節,經報道的工具葯有:
(一)自噬誘導劑
1)Brefeldin A / Thapsigargin / Tunicamycin :模擬內質網應激
2)Carbamazepine/ L-690,330/ Lithium Chloride(氯化鋰):IMPase 抑製劑(即Inositol monophosphatase,肌醇單磷酸酶)
3)Earle's平衡鹽溶液:製造飢餓
4)N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑製劑
5)Rapamycin:mTOR抑製劑 (最常用)
6)Xestospongin B/C:IP3R阻滯劑
(二)自噬抑製劑
1)3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑製劑
2)Bafilomycin A1:質子泵抑製劑
3)Hydroxychloroquine(羥氯喹)
除了選用上述工具葯外,一般還需結合遺傳學技術對自噬相關基因進行干預:包括反義RNA干擾技術(Knockdown)、突變株篩選、外源基因導入等。
(三)自噬檢測方法:
細胞經誘導或抑制后,需對自噬過程進行觀察和檢測,常用的策略和技術有:
1)Western Blot檢測LC3的切割
利用Western Blot檢測LC3-II/I比值的變化以評價自噬形成。自噬形成時,胞漿型LC3會酶解掉一小段多肽形成LC3-I,LC3-I跟PE結合轉變為(自噬體)膜型(即LC3-II),因此,LC3-II/I比值的大小可估計自噬水平的高低。
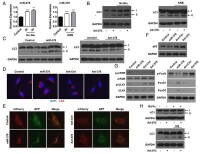
LC3-II切割帶與自噬水平同比例升高
GFP-LC3 單熒光自噬指示體系:
利用LC3在自噬形成過程中發生聚集的原理,開發出 GFP-LC3指示技術徠:無自噬時,GFP-LC3融合蛋白彌散在胞漿中;自噬形成時,GFP-LC3融合蛋白轉位至自噬體膜,在熒光顯微鏡下形成多個明亮的綠色熒光斑點,一個斑點相當於一個自噬體,可以通過計數來評價自噬活性的高低。但是綠色斑點增多並不一定代表自噬活性增強,也有可能是自噬溶酶體降解途徑受阻,可以通過western blot 檢測遊離的GFP、p62來驗證。
另一種方法是利用mRFP-GFP-LC3 。
mRFP-GFP-LC3 雙熒光自噬指示體系:
由於分子生物學的發展,現在已經誕生了 mRFP-GFP-LC3 雙熒光自噬指示體系,用於標記及追蹤LC3以及自噬流的變化。其中GFP是酸敏感型GFP蛋白,而mRFP是穩定的熒光表達基團,不受外界影響。由於自噬小體進入第二階段后,與溶酶體進行融合,形成自噬溶酶體。自噬溶酶體由於溶酶體內部的酸性環境,可以導致PH下降,GFP淬滅,因此,GFP的減弱可指示自噬溶酶體形成的順利程度,GFP越少,則從自噬小體到自噬溶酶體階段流通得越順暢。反之,自噬小體和溶酶體融合被抑制,自噬溶酶體進程受阻。mRFP是一直穩定表達的,因而可以通過GFP與mRFP的亮點比例來評價自噬流進程。
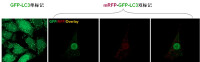
單標/雙標記LC3對比圖(點擊放大)
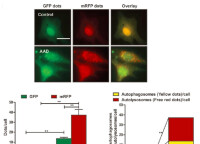
RFP-GFP-LC3的自噬流定量比較(點擊放大)
自噬經歷了:吞噬泡(phagophore)--自噬小體(autophagosome)--自噬溶酶體(autolysosome)
透射電鏡下吞噬泡(phagophore)的特徵為:新月狀或杯狀,雙層或多層膜,有包繞胞漿成分的趨勢。自噬小體(autophagosome)的特徵為:雙層或多層膜的液泡狀結構,內含胞漿成分,如線粒體、內質網、核糖體等。自噬溶酶體(autolysosome)的特徵為:單層膜,胞漿成分已降解。
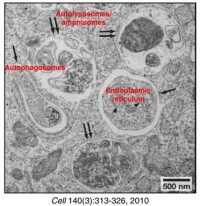
透射電鏡下觀察自噬體的形成
