共找到4條詞條名為多巴胺的結果 展開
- 幫助細胞傳送脈衝化學物質
- 藥物
- 兒科用藥
- 美國2003年馬克·戴森納執導電影
多巴胺
幫助細胞傳送脈衝化學物質
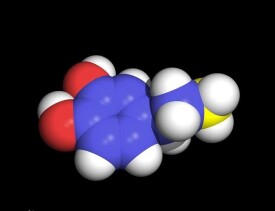
多巴胺是大腦中含量最豐富的兒茶酚胺類神經遞質。多巴胺作為神經遞質調控中樞神經系統的多種生理功能。多巴胺系統調節障礙涉及帕金森病,精神分裂症,Tourette綜合征,注意力缺陷多動綜合征和垂體腫瘤的發生等。
多巴胺是一種神經傳導物質,用來幫助細胞傳送脈衝的化學物質。
阿爾維德·卡爾森(Arvid Carlsson)確定多巴胺為腦內信息傳遞者的角色,使他贏得了2000年諾貝爾醫學獎。

多巴胺
多巴胺具有β受體激動作用,也有一定的α受體激動作用,能增強心肌收縮力,增加心排血量,加快心率作用較輕微,對周圍血管有輕度收縮作用,升高動脈壓,對內臟血管則使之擴張,增加血流量,使腎血流量及腎小球濾過率均增加,從而促使尿量及鈉排泄量增多,能改善末梢循環,明顯增加尿量,對心率則無顯著影響,為其優於其他血管收縮劑或血管擴張劑之處,臨床主要可用於各種類型休克。
多巴胺雖早在1910年即已被合成,但與其密切相關的生物源兒茶酚胺(即腎上腺素和去甲腎上腺素)相比,由於相對較弱的擬交感神經活性而長期地被忽視了。一直到在動物組織內發現了α-多巴脫羧酶,多巴胺才作為正常人尿液中的組成成分而被觀察后。多巴胺在正常腦內的濃度至少與去甲腎上腺素一樣高的事實啟示,多巴胺除了作為去甲腎上腺素的前體以外,還可能有其他功能。臨床上常用的是鹽酸鹽和溴化氫鹽。即使是多巴胺鹽,在空氣和光照下也容易被氧化。多巴胺溶液在弱酸性條件下比較穩定,而在鹼性條件下則易被逐漸氧化。多巴胺的這一特性,近來已經被用於建立在體內和體外實驗中都能敏感地測定多巴胺及其代謝產物的電化學技術。
含多巴胺的神經元,其細胞體主要分佈在黑質、腳間核和丘腦下部等處。在這些區域多巴胺含量很高。多巴胺在機體內合成時以酪氨酸為原料。腦內的多巴胺主要是由黑質細胞來合成,這些多巴胺參與錐體外系統的活動,與軀體運動機能有密切關係。腦內多巴胺代謝失常時,可引起震顫性麻痹(帕金森震顫)。其癥狀是:全身肌肉緊張度增高,肌肉強直,隨意運動減少,動作緩慢,面部表現呆板。患者靜止時,上肢或下肢及頭部震顫;情感激動時震顫增加;進行自主運動時震顫減少;入睡后震顫停止。中腦邊緣部分的多巴胺神經元位於中腦腳間核,這些區域的多巴胺和精神活動的調節有關。有人認為精神分裂症是腦內這些部位的多巴胺過多的結果。由下丘腦弓狀核發出的軸突到達靠近垂體的正中隆起,這些多巴胺神經元與垂體的某些分泌(特別是促性腺素的分泌)有關。
多巴胺受體
多巴胺受體是結合在膜上的供神經遞質多巴胺識別的位點。多巴胺受體既存於中樞神經系統(CNS),也存在於外周。依據生化和藥理學標準已將此受體分為二型。微摩濃度的多巴胺作用於D1多巴胺受體可刺激腺甘酸環化酶的活性。酚噻嗪類多巴胺拮抗劑如氟非那嗪作用非常強大,抑制多巴按D1受體效應只需納摩水平,而丁醯苯類拮抗如像氟哌啶醇的藥效則弱得多,在微摩波度才顯示效應。具有多巴胺效應的麥角類則是D1受體弱的部分激動劑。相反,納摩濃度的多巴胺激動劑作用於D2受體就能抑制由其他激素或者神經遞質激活的腺苷酸環化酶活性。對D2受體來說,酚噻嗪類和丁醯苯類作用效應是納摩級的,而且多巴胺效應的麥角則是作用強大的完全激動劑。苯醯胺類抗精神病藥物,如舒必利作為拮抗劑其效力為納摩到微摩級,但它們對D1多巴胺受體無作用。
D1和D2多巴胺受體都典型地發現於對多巴胺神經末梢是突觸后的成分,兩類受體也見於皮層-紋狀體的末梢,在此多巴胺末梢與谷氨酸能末梢形成軸突-軸突型突觸以調節谷氨酸的釋放。重要的是,在多巴胺細胞胞體,樹突和末梢都有多巴胺受體發現。這些自身受體既調節多巴胺的合成、釋放,也調節神經元的衝動發放頻率。從藥理學角度看,這些受體似與D2受體性質相似。刺激腦內多巴胺受體產生的確切行為變化尚不清楚。多巴胺通過在錐體外運動系統中的作用肯定參與運動調節。當黑質紋狀體多巴胺通路受損時,將導致帕金森病的運動功能喪失或運動不能的產生。多巴胺似乎也參與攝食和攝水的增強和調節。
D2多巴胺受體也存在於垂體前葉和中葉。在垂體前葉,多巴胺抑制催乳素細胞釋放催乳激素。下丘腦弓狀核中的多巴胺細胞體釋放多巴胺入門脈系統,隨血流入垂體前葉。在垂體中葉,多巴胺通過抑制由β2-腎上腺素能受體激活的腺苷酸環化酶活性以調節α-促黑激素(α-MSH)的釋放。多巴胺受體也存在於外周:在交感神經末梢上的D2受體,可抑制去甲腎上腺素的釋放;D1受體則主要存在於腎血管網上,受刺激時可引起血管擴張。兩型受體還見於視網膜無長突細胞層,但其功能還不清楚。
受體的分佈
在缺乏每種多巴胺受體亞型的特異配體之前,廣泛應用原位雜交的方法來研究多巴胺受體mRNAs在腦內的分佈。D1和D2受體基因在腦內表達廣泛。D1-R主要表達於尾殼核,伏隔核,視束,腦皮層和杏仁核。除此之外,D1受體還在下丘腦被探測到。儘管在黑質緻密部發現有D1配體與其結合,但沒有探測mRNA存在。這一結果提示:D1-R在紋狀體合成后通過紋狀體黑質束轉運到黑質。D5-R和D1-R相比表達局限,僅在海馬,外側乳頭體核和下丘腦束旁核表達。D2-R mRNA主要在腦的CPu, OT和Acb中表達。在黑質和腹側被蓋部(VTA)也有表達,這些區域發出多巴胺纖維,提示著D2-R有突觸前定位。相反,D1樣受體只有廣泛的突觸后定位。分析D2樣受體的兩種亞型的mRNA表明D2L表達最為豐富。在腦外,D2-R mRNA還定位於視網膜,腎臟,血管系統和垂體。大鼠腦D3-R的mRNA分佈僅限於隔核,下丘腦和丘腦,以及小腦中的某些區域。D3-R還分佈於黑質緻密部,提示它也存在突觸前定位。在前額葉皮層,杏仁核,嗅球,海馬,丘腦和中腦可見D4-R的mRNA高度表達。
應用多巴胺受體亞型特異抗體可對其在不同腦區進行細胞和亞細胞定位。D1和D5受體共同表達於前額葉皮層,運動前區,扣帶和內嗅皮層,海馬和齒狀回的錐體細胞。電子顯微鏡證實D1和D5受體存在於前額葉皮層,海馬的突觸前和突觸后,以突觸後分佈更常見。超微結構分析發現:D1和D5受體在人錐體細胞分佈不同,D1受體集中在樹突棘,D5受體集中位於樹突軸。在嗅球,D1受體限於內顆粒層和內從層;在杏仁核,其限於中介核和基底外側核。在尾狀核,D1和D5受體大多數位於中等大小的GABA能神經元。D5受體也存在於大的膽鹼能中間神經元。超微結構分析發現: D1受體存在於非對稱性突觸的突觸后樹突棘部, D1和D5受體位於多巴胺終端特徵性小突觸的突觸后樹突上,以及突觸前D1和D5受體位於形成非對稱性突觸的軸突上。已明確D1受體位於腳內核和黑質網狀部,這些區域並未檢測到D5受體。這一結果提示:如果D1和D5受體在尾狀核中等大小多棘神經元共存,只有D1受體被轉移到紋狀體靶區終端。儘管D1和D5受體有著相似的藥理學特性,但細胞和亞細胞定位不同提示它們在功能上可能不同。用特異抗體的免疫組化方法顯示:D2受體存在於紋狀體中等多棘神經元,在棘突和棘頭的分佈比胞體密集。與D1受體的共存非常罕見。D2免疫反應終端形成的對稱性突觸多於非對稱性突觸。D2受體存在於黑質緻密部的核周體和樹突,和其他紋狀體投射相比,更集中於蒼白球外段。D2受體免疫陽性反應還可在嗅球的顆粒層和內從層以及杏仁核見到。免疫組化和電子顯微鏡揭示了D4受體存在於大腦皮層和海馬的錐體和非錐體神經元,它們已被證實是GABA能中間神經元。在大腦皮層和海馬,D4受體調控GABA的傳遞。D4受體也在蒼白球片段,黑質網狀部以及丘腦網狀核的GABA能神經元內被發現。
運動
多巴胺對運動控制起重要作用,帕金森病是由於多巴胺能神經元變性引起嚴重的多巴胺減少所致。多巴胺拮抗劑和激動劑應用的研究表明了多巴胺受體在運動控制中的重要作用如:大鼠的前進,後退,僵直,吸氣和理毛功能。通常激動劑提高多巴胺的運動功能,拮抗劑作用相反。已明確了在決定向前運動中的D1和D2受體有相互促進作用。
同時刺激D1受體可使D2受體激動劑產生最大的運動刺激。對多巴胺受體(D1-4)基因突變鼠的行為分析可提供每一種運動亞型。與藥理學研究結果相反,D1-R突變鼠的運動功能和野生型鼠相比未受影響,說明了在調控自主運動過程中不同多巴胺受體之間相互作用的複雜性。D2-R敲除鼠出現明顯的運動功能受損,如運動減少,不協調或後退不能。D3-R突變鼠出現運動過度的運動亞型,與應用藥理學方法給予D3-R激動劑或拮抗劑的結果一致。D4-R突變鼠的運動功能也受到影響。
藥物成癮
中腦邊緣多巴胺系統與藥物成癮包括阿片,可卡因,安非他命和乙醇等造成的精神運動效應以及獎勵機制的控制有關。可卡因和安非他命通過阻斷多巴胺轉運子(DAT)的活動,翻轉多巴胺的運輸增加多巴胺在突觸間隙的釋放。然而,阿片在紋狀體,前額葉皮層,視束,伏隔核,下丘腦內側基核和杏仁核對多巴胺的釋放起抑制效應。已證明破壞伏隔核,或用D1或D2-R拮抗劑阻斷多巴胺受體,可削弱嗎啡,可卡因和安非他命引起的運動過度和獎勵效應。D1-R敲除鼠行可卡因治療后,不出現經典的運動過度和刻板的行為效應。在地點選擇性實驗模型中,D2-R敲除鼠和野生型鼠相比缺乏對嗎啡的條件反射。D3-R突變鼠對可卡因的敏感性增加。D4-R突變鼠對乙醇,可卡因,安非他命引起的運動活動刺激更加敏感。
學習記憶
普遍認為中腦邊緣多巴胺系統和中腦皮層多巴胺系統在學習記憶中發揮作用。有報道,猴A10區多巴胺能神經元涉及學習認知行為中基本注意力和動機過程中的衝動活動的短暫變化。
D1和D2受體可調節多巴胺在學習記憶中的作用。許多實驗表明多巴胺通過D1-R調控前額葉皮層(PFC)神經元的活動和工作記憶過程。D2和D3-R基因缺陷鼠和野生鼠相比,出現延遲交替作業有關空間記憶缺陷,預先給予METH(metaphetamine)處理的突變鼠的空間學習能力未受損,說明D2-R調節學習記憶機制是通過D1-R介導的。研究發現,健康志願者口服D2-R激動劑溴隱亭,可提高空間學習記憶的能力;而口服D2-R拮抗劑,可出現空間識別能力損害,且呈劑量依賴性下降。
腦老化
隨著年齡的增長,認知功能將隨之下降這一事實,在人類和靈長類中都得到了很好的證明。近年來有研究提供了直接的證據,證明了多巴胺功能下降,認知功能下降和腦老化的明顯相關性,對同年齡的志願者進行對比性研究,其結果表明,多巴胺水平與認知功能呈正相關,與年齡呈負相關。
長時程增強(LTP)
長時程增強為目前神經科學家所認同的學習記憶的細胞模式。在自由活動的大鼠海馬齒狀回顆粒細胞層植入慢性記錄電極,在中前通路植入刺激電極,同側腦室植入套管給葯,發現預先給予D2樣受體阻滯劑remoxipride可抑制海馬弱的LTP(<4 h),說明D2樣受體通過調控體內海馬LTP和去極化涉及學習記憶的相關過程。對培養的皮層紋狀體細胞腦片進行細胞內記錄研究,發現用內源性多巴胺或外源性多巴胺激動劑激活多巴胺D1/D5受體對皮層紋狀體通路的LTP的誘導是必需的。
合成和儲存
酪氨酸由飲食蛋白提供,或由苯丙氨酸經肝臟苯丙氨酸羥化酶轉換而成,經氨基酸轉運體入腦,多巴胺神經元,經胞漿酪氨酸羥化酶轉換成二氫苯丙氨酸(左旋多巴),再由芳香氨基酸脫羧化酶(多巴脫羧化酶)轉換成多巴胺。胞漿多巴胺轉運至囊泡,囊泡多巴胺濃度為0.1M。
釋放
當動作電位到達時,膜蛋白構造改變,允許Ca2+流入,囊泡與神經末梢或樹突融合,通過胞吐作用將多巴胺釋入突觸間隙。有兩種釋放方式:一種是間斷性釋放,即動作電位到達時一過性釋放多巴胺,然後快速回收入神經元;一種是持續性釋放,即低水平持續釋放多巴胺,此時的多巴胺水平不足以激動突觸后膜多巴胺受體,只能激動突觸前膜多巴胺自身受體,抑制間斷性釋放。
回收和代謝
中科院上海生命科學院神經科學所發現一種小G蛋白的調節因子Vav2能夠通過調節多巴胺轉運體在質膜的分佈,從而顯著改變多巴胺“回收泵”系統的轉運效率。如果將Vav2基因敲除,“回收泵”功能異常提升,就會使大腦伏隔核多巴胺的含量明顯升高。為了尋找控制多巴胺“回收泵”的“開關”,研究人員利用分子生物學實驗手段篩選到膠質細胞源性神經營養因子GDNF的受體Ret。研究結果顯示,GDNF和Ret可作為撥動和調節多巴胺“回收泵”的“開關”而起作用。當這套“開關”失靈(如Ret基因敲除)的時候,動物呈現類似於Vav2基因敲除小鼠的表現。過去一般認為,GDNF及其受體Ret主要是掌管多巴胺能神經元的存活,因此,他們的這一發現拓展了人們對神經營養因子 GDNF作用的傳統認識。
多巴胺受體
能結合SCH23390的稱為多巴胺D1受體, D1受體與興奮性核苷酸結合蛋白複合物相互作用,激活腺苷酸環化酶系統;能高親和性結合丁醯苯類藥物(螺哌隆和氟哌啶醇)的稱為D2受體,D2受體與抑制性核苷酸結合蛋白複合物相互作用,抑制腺苷酸環化酶系統。重組DNA技術將這兩種受體再分,多巴胺D1樣受體再分為D1和D5受體,多巴胺D2樣受體再分為D2、D3和D4受體。
通路
多巴胺神經元位於中腦與間腦交接處,有3條通路。第一條是黑質-紋狀體通路,第二條是中腦-邊緣通路,第三條是中腦-皮質通路。
(1)黑質-紋狀體通路
黑質-紋狀體通路起自黑質緻密帶,投射至尾核-殼核,該通路激活能增加運動,動物黑質損害能引起運動遲緩和反應時間延長。抗精神病葯阻斷多巴胺D2受體,表現為錐體外系反應。
(2)中腦-邊緣通路
該通路起自腹側被蓋區外側神經元,多數投射到伏膈核和嗅結節,少數投射到中膈、杏仁核和海馬,激動時引起愉快體驗,抑制則引起心緒不良。當睾酮升高時,增加 γ-氨基丁酸(GABA)回收,多巴胺突觸前膜上的GABAA受體激動不足,導致多巴胺脫抑制性釋放,男、女性喚醒和性享受增加。
(3)中腦-皮質通路
該通路起自腹側被蓋區內側神經元,投射至前額內側、鼻周皮質。當機體暴露有意義的新刺激時,中腦腹側被蓋區釋放多巴胺,引起警覺,當反覆暴露該刺激時,機體熟悉后,就不再釋放多巴胺。激動額葉皮質與紋狀體複合物環路時,反映了興趣或厭惡的強度,即精神動力。多巴胺增強這種精神動力,多巴胺阻斷劑則削弱這種精神動力,表現為情感淡漠和意志缺乏,稱為繼發性陰性癥狀。
額葉皮質多巴胺升高時,激動D1受體能改善注意、目標指向行為、犒賞和學習。苯丙胺阻斷多巴胺回收,從而激動D1受體,改善認知功能;典型抗精神病葯阻斷D1受體,損害認知功能;不典型抗精神病葯阻斷多巴胺神經纖維突觸前膜上的5-HT2A受體,引起多巴胺脫抑制性釋放,改善認知功能。
(4)中腦-邊緣-皮質多巴胺通路
儘管描述中腦-邊緣通路的多巴胺神經元在腹側被蓋區外側,中腦-皮質通路的多巴胺神經元在腹側被蓋區內側,但兩者還是有相當大的重疊,故有時統稱中腦-邊緣-皮質多巴胺通路,其激活能增加精神動力。隨著年齡的增加,多巴胺受體減少,這可能解釋老人的動力和快感不如青少年強。
(5)反饋通路:紋狀體-黑質神經元和中腦局部環路
神經元釋放GABA,激動GABAA和GABAB受體,抑制多巴胺神經元。苯二氮 類藥物激活GABAA受體,通過抑制多巴胺神經元而惡化抗精神病葯的錐體外系反應,另一方面,通過肌肉鬆弛效應而改善錐體外系反應,如此一反一正,故苯二氮類藥物未推薦為治療錐體外系反應。
基底前腦
伏膈核富含多巴胺神經元;分為兩部分:中央為“核”,邊緣為“殼”,殼是杏仁核的延伸部分。活體微透析分析發現,天然犒賞(如食物、水、性和其他愉快性刺激)增加伏膈核多巴胺釋放。相反,杏仁核促進害怕行為,而前額皮質則調節總動機,決定行為反應的強度。弗洛伊德愛的本能、恨的本能和自我,分別可用這三個解剖部位解釋,這三個解剖部位的關係可用一個人低頭作揖來模擬,雙手抱拳相當於伏膈核核部,兩前臂相當於伏膈核殼部,兩上臂相當於杏仁核,頭部相當於前額皮質,可以這樣記:愛的中樞(伏膈核)在中間受到呵護,恨的中樞(杏仁核)在雙側護衛,上端有前額皮質調控。這三個解剖部位加上嗅結節,稱為基底前腦。
犒賞通路
多巴胺犒賞通路是指腹側被蓋區投射至基底前腦的內側前腦束。籠統地講,是從中腦被蓋區投射到前額皮質,激動釋放多巴胺,經前額皮質-伏膈核核部谷氨酸通路激活伏膈核,引起尋藥行為。當抑制中腦被蓋區、前額皮質和伏膈核這三個環節的任何一個環節時,都能阻止覓藥行為。
犒賞遞質
有兩種,一種是多巴胺,與鼓勵和準備獲得犒賞相關聯,如動物交媾前的交配儀式、人類調情的愉快、用藥前線索(如看電影上的人注射海洛因)引起的愉快渴望,表現為一陣激動感、迫切感或渴望感;另一種是阿片類物質,與圓滿犒賞相關聯,包括鎮靜、休息和“極樂感”。如急性飲酒能刺激 β-內啡肽釋放,引起圓滿犒賞。
多巴胺激聯
成癮性毒品刺激多巴胺過量釋放→激動多巴胺D1受體→興奮性核苷酸結合蛋白複合物增多→腺苷酸環化酶增多→環-磷酸腺苷增多→蛋白激酶增多→環-磷酸腺苷反應成分結合蛋白磷酸化→誘導立即早期基因產物(如cFos)→短期神經形成改變→急性犒賞效應。
當犒賞通路多巴胺能低下時,引起快感缺失(不能體驗到愉快)、情感淡漠(缺乏動機)和心緒不良(感到不滿意、不幸福、痛苦、激惹和緊張不安)。
快感缺失
(1)心境惡劣
假定素質性伏膈核多巴胺能低下導致持續的快感缺失,表現為持續2年以上的心境惡劣。由於青少年時期的基礎多巴胺能最低,故青少年起病。當給予犒賞刺激時,多巴胺一陣釋放,引起犒賞效應,心境惡劣暫時緩解;犒賞刺激消失,多巴胺再度低下,再次陷入心緒惡劣。即使犒賞刺激持續存在,由於不再新穎,多巴胺不再釋放增加,病人也會再次心緒惡劣,這可解釋心境惡劣緣何波動,緣何有不足2個月的緩解期。
心境惡劣有一個特點,就是無論用什麼抗抑鬱葯,起初多少有效,過一段時間後效力減退,可能是這些藥物作為一種新穎刺激(安慰劑樣效應),引起多巴胺一陣釋放,時間一長,該刺激不再新穎,多巴胺釋放不再釋放增加,再次陷入心境惡劣狀態。
(2)重性抑鬱症
當犒賞通路多巴胺能非常低下時,引起嚴重的快感缺失,這是抑鬱症的一項核心癥狀,重性抑鬱症通過物質使用障礙(Substance useddisorder)而增加伏膈核多巴胺能,改善快感缺失,其物質使用障礙率比普通社區人群為高(27%:17%)。丁氨苯丙酮抑制去甲腎上腺素和多巴胺回收,治療三環抗抑鬱葯難治的抑鬱症有效。
(3)精神分裂症
一些精神分裂症病人服用抗精神病葯、活動缺乏、失業、生活在低社交環境中,引起多巴胺能不足,表現為快感缺失或心緒不良,病人選擇物質濫用,增加多巴胺能,緩解快感缺失和心緒不良。故精神分裂症的物質濫用率是常人的4倍,包括酒中毒和大街藥物濫用,如果服抗精神病葯期間主觀幸福感高,則濫用物質率低。
情感淡漠
(1)淡漠形成
如果遺傳或圍產期因素導致兒童突觸密度低,到青少年期再修剪一次,導致突觸聯繫過度減少;或原來突觸密度不低,但青少年期過度修剪,導致突觸聯繫過度減少。當額葉皮質多巴胺突觸聯繫過度減少時,表現認知障礙(注意和語言表達缺損)、陰性癥狀(包括情感淡漠)和快感缺失/心緒不良。額葉皮質多巴胺突觸聯繫過度減少還導致皮質-邊緣谷氨酸-γ-氨基丁酸通路功能低下,該通路本來能抑制中腦-邊緣多巴胺能通路,當功能低下時,中腦-邊緣多巴胺能通路功能亢進,多巴胺釋放增加,過度激動多巴胺D2受體,引起陽性癥狀(如幻覺妄想)。
(2)預報因素
同源相關假說認為,一種原因(多巴胺能不足)依賴於程度引起多種結果(快感缺失/心緒不良、情感淡漠和陽性癥狀),則多種結果之間應有相關性。故青少年期的快感缺失可能預示其易情感淡漠和陽性癥狀。
心緒不良
(1)主觀體驗
精神藥物可引起三種主觀體驗:正性、中性和負性,可卡因、苯二氮 類藥物和許多非法藥物引起過強的正性體驗(“刺激”或“高潮”),促進其反覆使用,引起依賴和濫用;抗抑鬱藥引起中性或正性體驗,促進治療依從性;抗精神病藥引起負性體驗(如心緒不良),導致治療不依從。
(2)生化機制
精神分裂症伏膈核多巴胺基礎水平就低,抗精神病葯阻斷伏膈核D2受體,引起心緒不良,發生率10%~60%。初步證據表明,當佔領D2受體不足60%時,病人仍處精神病狀態,可伴負性3主觀幸福感;當佔領60%~70%時,主觀體驗最理想,可增加治療依從性和生活質量;當高於70%時,則引起心緒不良。
(3)癥狀影響
有學者提出,靜坐不能和運動不能決定了抗精神病藥引起心緒不良的程度,即使是輕微的靜坐不能,也能引起心緒不良。一位運動不能的女病人說,我服藥后像一個老太,這對我的形象有重要影響。同樣,過度鎮靜也可引起心緒不良。
(4)早期預測
有研究表明,住院精神分裂症病人服氯丙嗪試驗劑量,如出現心緒不良,預示後來療效差。對氨碸噻噸的研究表明,如首服劑量4~24小時內出現心緒不良,則病人可能立即或最終不肯服藥,進而預后差。因此,當給病人選擇抗精神病葯時,應考慮病人既往的主觀體驗報告。
(5)導致後果
心緒不良影響生活質量和功能狀態,惡化治療關係,導致服藥不依從,後者導致疾病復燃率升高,預后差,甚至引發自殺。不典型抗精神病葯的心緒不良少得多。機制可能是:不典型抗精神病葯阻斷5-HT2A受體,引起多巴胺脫抑制性釋放,部分抵消D2受體的阻斷效應。一項為期2年的研究表明,服利培酮組比服氟哌啶醇組的主觀體驗好,伴發的焦慮和抑鬱少。儘管奧氮平引起的靜坐不能較少,但比氟哌啶醇組的主觀體驗無明顯優勢。
作用與用途
可激動交感神經系統腎上腺素受體和位於腎、腸系膜、冠狀動脈、腦動脈的多巴胺系統。效應與劑量有關:小量時,每分鐘按體重0.5~2μg/kg使腎及腸系膜血管擴張;而小到中量,每分鐘按體重2~10μg/kg對心肌產生正性應力作用;大量時,每分鐘按體重大於10μg/kg,使腎血流量減少,收縮壓及舒張壓增高。適用於洋地黃及利尿葯無效的心功能不全。用於心臟手術、腎功能衰竭、充血性心力衰竭、心肌梗死、內毒素敗血症、創傷等引起的休克綜合征及補充血容量效果不佳的休克。
用法與用量
成人常用量:靜滴開始時按每分鐘1~5μg/kg,10分鐘內以每分鐘1~4μg/kg的速度遞增而達最佳療效。慢性頑固性心衰可每分鐘按0.5~3μg/kg可生效。閉塞性血管病變患者開始按每分鐘1μg/kg速度靜滴,漸增直到每分鐘20μg/kg,以達最佳療效。如危重病例可先以每分鐘5μg/kg滴注,然後增至每分鐘20~50μg/kg。
注意事項
應用本品前應先糾正血容量,同時監測血壓、心率、心律、尿量。外周血管灌流情況,休克糾正時應即減慢滴速,不可突然停葯。防止藥液外漏,選用粗大靜脈。常見不良反應有胸痛、呼吸困難、心律失常(快而有力)、乏力、頭痛、噁心、嘔吐,長期使用可能導致局部壞死或壞疽,過量時發生嚴重高血壓。對本品過敏者、孕婦、小兒慎用;閉塞性血管病、肢端循環不良、頻發室性心律失常者慎用。嗜鉻細胞瘤患者不宜使用。α受體阻滯劑、β受體阻滯劑可拮抗本品的作用;與硝酸酯類合用,互相減弱作用;與硝普鈉、異丙腎上腺素、多巴酚丁胺合用時注意心排血量的改變;與全麻藥合用時引起室性心律失常。本葯可加強利尿劑的作用;與苯妥英鈉聯用時需交替使用;而與三環類抗抑鬱葯或單胺氧化酶合用可增強和延長本品的效應。
休克
微循環動脈血灌流急劇減少,致重要生命器官因缺氧而發生功能和代謝障礙,是各種休克發生髮展的共同規律。因此,休克的治療應著重於儘快改善微循環,而不應單純追求一個“滿意”的血壓。休克的恢復取決於微循環的改善,而不單純取決於提升血壓。在治療休克時除常規擴容、積極處理原發疾病、糾正酸鹼平衡失調外,根據病情需要及時應用DA,對於休克早期應該給予中小劑量的,使腎、腦、腸等重要器官的血管擴張,使有限的血流重新分配,同時又能使心輸出量有所增加,血壓適當提高。尤其適用於伴有心肌收縮力減弱、尿量減少而血容量已補足的休克患者。而對於頑固性低血壓或感染性休克時,在使用大劑量效果仍不佳時,應及時改用血管收縮劑去甲腎上腺素。
心力衰竭
心力衰竭的主要特點是體液儲留,導致肺淤血和外周水腫,造成呼吸困難和乏力,限制了運動耐量。因此有效改善體液儲留可緩解患者的心力衰竭癥狀。首先對該類患者應用利尿劑治療是必不可少的組成部分,而且必須儘早應用。另外在使用擴血管藥物如硝普鈉治療心力衰竭時,聯用DA可以起到協同、互補作用。因為在加強心肌收縮力而使心排出量有更大程度增加的同時,又可糾正在應用硝普鈉時因前負荷減少而心排出量降低的情況,加之可維持血壓,使硝普鈉的使用範圍擴大,不必擔心血壓降低不良反應。
腎臟“保護”
傳統觀念認為小劑量即所謂“腎劑量”DA有利尿保護腎臟作用,其機製為:(1)興奮近曲小管血管上的受體產生腎血管擴張作用,增加腎血流量及腎小球濾過率,促進排鈉、利尿;(2)抑制近端腎小管、髓拌升支以及皮質集合管處的鈉-鉀-ATP酶活性產生利尿作用;(3)使具有拮抗抗利尿激素作用的前列腺素E2產生增多而利尿;(4)激動β1受體,增加心輸出量,增加腎灌注而增加尿量。
支氣管哮喘
支氣管哮喘是一種氣道慢性炎性反應,臨床上表現為反覆發作性喘息、呼氣性呼吸困難、胸悶或咳嗽等癥狀,常在夜間和或清晨發作、加劇,常常出現廣泛多變的可逆性氣流受限,多數患者可自行緩解或經治療緩解。DA可直接興奮氣道平滑肌和肥大細胞膜表面的受體,舒張支氣管平滑肌,減少肥大細胞和嗜鹼性粒細胞脫顆粒和介質的釋放,降低微血管的通透性。另外小劑量DA對外周血管有選擇作用,可使腎血管、腸系膜血管、冠狀動脈、腦血管擴張,使微循環得到改善,心臟前後負荷減輕,起到強心、利尿,保證重要器官血流灌注的作用。
D2受體功能低下
正電子發射計算機斷層掃描研究顯示,非藥物濫用者服利他林(阻斷多巴胺轉運體),引起快感者腦D2受體基礎水平低,不引起快感者腦D2受體基礎水平高。提示當D2受體基礎水平低時,提高多巴胺易引起快感。在現實中,基礎多巴胺D2功能低下導致快感缺失,他們會通過暴食、性慾過強、賭博、冒險行為和服成癮藥物(如可卡因、苯丙胺、酒精、大麻、阿片類物質和尼古丁等)刺激多巴胺系統,以保證快感。
增加多巴胺能
阿片和大麻激動μ受體,從而增加多巴胺能;大麻的活性代謝物是 Δ-9-四氫大麻,通過刺激腹側被蓋區而增加伏膈核和前額皮質的多巴胺釋放;酒精和苯環乙哌啶通過拮抗N-甲基-D-天門冬氨酸受體而使多巴胺脫抑制性釋放;尼古丁通過激動尼古丁受體而增加多巴胺釋放,苯丙胺刺激多巴胺釋放;可卡因阻斷多巴胺回收;均增加多巴胺能,引起快感。
易感藥物濫用者
在青少年時期,中腦-邊緣通路的多巴胺基礎水平低下,這種低下可引起厭煩和不滿意。當藥物誘發多巴胺釋放時,其釋放量比成人為多,造成的犒賞效應比成人為大,故易感藥物濫用。習慣性服用濫用藥物后,中腦-邊緣多巴胺通路發生耐受,同等藥量不再引起多巴胺釋放增加,快感不再出現,需要更大藥量才能引起多巴胺釋放增加,再度出現快感,此稱藥效耐受。當濫用藥物撤退時,多巴胺水平低於基線水平以下,引起快感缺失和心緒不良,強制病人繼續用藥,引起藥物依賴。
增加精神癥狀
許多研究顯示,大麻使用障礙的精神分裂症病人治療合作性低,精神病陽性癥狀更多,再住院率高,但低劑量大麻能緩解焦慮和抑鬱。這從機理上可得到解釋,因為大麻增加多巴胺能,而多巴胺D2受體過度激活能惡化精神分裂症陽性癥狀;低劑量大麻輕度增加多巴胺能,引起快感,故緩解焦慮和抑鬱。多巴胺激動“犒賞”通路,故擬多巴胺藥物可治療某些藥物(如可卡因)依賴。
製備方法
多巴胺作為反應單體,鹼性條件下(pH>7.5),氧氣為氧化劑,反應過程不需要複雜的實驗儀器和步驟,當多巴胺(通常選用多巴胺鹽酸鹽)在避光有氧的鹼性條件下,即可發生聚合,在聚合的過程中溶液的顏色會隨著時間的推移逐漸發生變化,顏色由無色變為棕色最後變為黑色。在鹼性條件下,多巴胺單體鄰苯二酚去質子氧化后可以形成多巴胺醌,但多巴胺醌的結構不穩定會被繼續氧化,發生分子內重排和交聯,形成深褐色的聚多巴胺。如果將聚多巴胺塗覆在不同的底物表面,只需將底物放在反應容器中輕輕振蕩。一定的反應時間后即可在底物表面生成一層均勻緻密的聚多巴胺塗層。多巴胺單體濃度控制在2g/L以上,形成的聚多巴胺薄膜厚度可通過反應時間的長短和多巴胺單體的濃度決定。研究表明,聚多巴胺薄膜的最大厚度為50nm,多巴胺單體的濃度和反應時間超過某一閾值后就不會再對膜的厚度造成影響。目前,除了溶液氧化法,還有酶氧化過程,利用酶催化聚合物合成。
聚多巴胺的應用
(1)聚多巴胺的結構特性
在不同的反應條件下,聚多巴胺的微觀結構也是不一樣的,雖然都屬於黑色素材料,但是通過電鏡微觀觀察,聚多巴胺(PDA)可以呈納米帶狀、納米球狀等不同形貌,不同結構的聚多巴胺材料隨著比表面積不同對污染物的吸附能力不盡相同,這要根據實際污水處理標準進行合理材料選擇製備。聚多巴胺穩定性好,水分散性強,生物相容性優秀。常溫下即可生成。製備不同結構特徵的聚多巴胺微/納米球可以通過控制氧化自聚的反應條件如多巴胺初始濃度、緩衝溶液的類型、反應時間等。聚多巴胺微/納米球中含有大量的氨基和酚羥基等基團,由於氨基和酚羥基可以與金屬離子結合,所以聚多巴胺微/納米球也會被應用在處理水污染中的重金屬離子。此外,聚多巴胺微/納米球可作為金屬離子的還原劑,製備金屬納米材料。
(2)聚多巴胺對膜的改性
研製一種表面能高、具有親水性的分離膜用來處理廢水中的污染物是科學家在膜技術領域致力的方向之一。實驗表明在鹼性有氧避光的條件下多巴胺能夠在各種基底表面發生氧化聚合反應,形成一層緻密且具有強黏附作用的複合層薄膜,在塗覆有聚多巴胺的薄膜表面接枝各種有利於目標污染物特異性吸附的改性分子或聚合物可以實現複合膜的功能化。
這種薄層複合納濾膜在海水淡化方面具有很好的應用前景。用膜吸附水環境中的污染物也屬於吸附法,製備各種複合膜來處理污水也是環境學家致力於研究的方向之一,用聚多巴胺不僅可以直接作為枝接物,還可以用作生物膠來連接不容易和膜黏附的化學物質。
(3)聚多巴胺對納米材料表面修飾
聚多巴胺除了可以修飾各種固體基底材料和膜材料之外,還可以對納米材料進行修飾。對於納米材料,多巴胺可以進行普通的塗覆作用,也可以進行二次功能化修飾。納米材料作為環境領域的一類新型吸附劑,具有很多優點,將聚多巴胺塗覆在納米材料表面可以實現這類吸附材料在環境治理的更大應用能力。
聚多巴胺(PDA)可通過多巴胺(DA)的自氧化聚合塗覆在多種基體表面。由於多巴胺具有黏附性、還原性以及生物相容性,多巴胺及其衍生的複合材料逐漸被應用在了各個領域,其中在環境領域,可以將多巴胺應用在膜技術和污染物的吸附等方面。
傳統的膜技術和吸附對需要改性的基底有較高的要求,而且在修飾過程中有可能對環境造成二次污染,但是,多巴胺的材料功能化會避免這種情況,整個製備過程也會是一個綠色環保、簡單易行、功能穩定的途徑。通過對固體、膜或者納米材料等基底的表面改性製備出新型多功能的材料應用在水處理當中,大大提高了吸附劑的吸附性能。如今已經有很多成功的例子可以證明這種材料在環境吸附中的重要地位,而且人們還在不斷探索它的創新應用。
國內對多巴胺在水環境處理的應用方面已經做出了許多科研成果,但是其只是停留在基礎研究階段,將多巴胺應用在實際的污水處理並將其產業化生產還不是非常廣泛。多巴胺在環境領域可以給人類帶來意想不到的作用。在國內外,多巴胺雖然已經廣泛地應用在各種材料功能化上面,但其聚合機理並不能準確把握,依然停留在探索階段,需要對其反應動力學及中間體的結構進行進一步研究,以拓展其應用領域。