脲
有機化合物
脲,是一個漢語漢字,拼音niào,基本含義:尿素,有機化合物,無色晶體,溶於水。廣泛用於塑料、藥劑和農業等生產中。
脲的常用組詞有氨硫脲。
脲 niào ㄋㄧㄠˋ
尿素,有機化合物,無色晶體,溶於水。廣泛用於塑料、藥劑和農業等生產中。
脲 niào
〈名〉
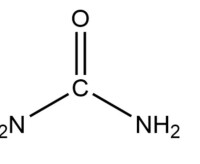
尿素 [carbamide;urea],有機化合物,分子式NH 2 CONH 2
中文名稱:尿素
中文別名:脲,碳醯二胺;碳醯二胺脲;
英文名稱:urea
英文別名:diaminomethanal;
CAS號:57-13-6
分子式:H2NCONH2
分子量:60.05530
精確質量:60.03240
PSA:69.11000
LogP:0.42440
外觀與性狀:白色結晶粉末
密度:1.335g/mLat 25°C
熔點:132-135°C
沸點:196.6ºC at 760mmHg
閃點:72.7ºC
折射率:n20/D 1.40
水溶解性:1080 g/L (20 ºC)
CAS號:57-13-6
MDL號:MFCD00008022
EINECS號:200-315-5
RTECS號:YR6250000
BRN號:635724
PubChem號:24900617
1、摩爾折射率:13.78
2、摩爾體積(cm/mol):49.5
3、等張比容(90.2K):135.0
4、表面張力(dyne/cm):55.3
5、極化率(10cm):5.46
1.疏水參數計算參考值(XlogP):-1.4
2.氫鍵供體數量:2
3.氫鍵受體數量:1
4.可旋轉化學鍵數量:0
5.互變異構體數量:2
6.拓撲分子極性表面積69.1
7.重原子數量:4
8.表面電荷:0
9.複雜度:29
10.同位素原子數量:0
11.確定原子立構中心數量:0
12.不確定原子立構中心數量:0
13.確定化學鍵立構中心數量:0
14.不確定化學鍵立構中心數量:0
15.共價鍵單元數量:1
有一定的吸濕性,加熱超過熔點時即分解。
本品應密封於陰涼乾燥處保存。
海關編碼:3102100001
WGK Germany:1
安全說明:S26-S36-S24/25
RTECS號:YR6250000
脲是一種由碳、氮、氧和氫組成的有機化合物,它是哺乳動物體內蛋白質代謝的最終產物,一個成年人每天的尿中可排出脲約30克。
生物以二氧化碳、水、天門冬氨酸和氨等化學物質合成脲。促使尿素合成的代謝途徑是一種合成代謝,叫做尿素循環。此過程耗費能量,卻很必要。因為氨有毒,且是常見的新陳代謝產物,必須被消除。肝臟在合成尿素時,需要N-乙醯谷氨酸作為調節。
脲含有官能團RR'N-CO-NRR'。這官能團的羰基帶著兩個有機的氨基。實驗室中,光氣可與此二氨基反應。脲類化合物包括過氧化脲、尿囊素、乙內醯脲。脲與縮二脲非常接近。脲的化學結構與醯胺、氨基甲酸、雙偶氮化合物、碳二亞胺等接近。
在許多有機反應中,如重氮化反應,常加脲以除去過量的亞硝酸,因此它是一個亞硝酸的捕捉劑。
脲能非常有效的使蛋白質變性,尤其能非常有效地破壞非共價鍵結合的蛋白質。
在氨水等鹼性催化劑作用下能與甲醛反應,縮聚成脲醛樹脂。
與水合肼作用生成氨基脲。
除了上面的一些性質以外,還有以下三點主要的化學性質。
● ● 脲(尿素)是一個一元鹼,可以與酸形成鹽,可以用下式表示
脲
脲
1773年伊萊爾·羅埃爾(Hilaire Rouelle)發現了脲。1828年,弗里德里希·維勒首次使用無機物質氰酸鉀與硫酸銨人工合成了脲。本來他打算合成氰酸銨,卻得到了脲。這一發現,推翻了“生命力”學說,開闢了有機化學新的篇章。
脲的大規模生產,是由在加溫加壓下,由二氧化碳和氨反應生成的。如右圖。
脲最主要的用途是作肥料(氮肥)
脲是一種優良的化學肥料,在施入土壤后受脲酶的作用,緩慢水解放出氨和二氧化碳,被植物吸收。(大豆中含有的大量的脲酶,是首次取得結晶型的酶,在生物化學發展上甚為重要)它也是製造藥物和塑料的重要化工原料。
由脲產生的二縮脲對作物有抑制作用,我國規定肥料用尿素二縮脲含量應小於0.5%。二縮脲含量超過1%時,不能做種肥,苗肥和葉面肥,其他施用期的尿素含量也不宜過多或過於集中。
少量的脲也可以用來製備巴比妥酸,它是一種重要的安眠劑。
皮膚科以含有尿素的某些藥劑來提高皮膚的濕度。非手術摘除的指甲使用的封閉敷料中,含有40%的脲。
人類糧食資源與蛋白質的短缺,也造成飼料工業一大難題。業者積極尋找蛋白質的新來源,並擴及蛋白質以外的氮來源,例如含氮量高的尿素。
1897年,Waesk 等人提出反芻動物能轉化非蛋白質氮為菌體蛋白質的想法。1949年,C. J. Watson 等人餵食綿羊含有N15標記的尿素膠囊,4天後在綿羊血液、肝臟、腎臟中檢驗出含有N15的蛋白質。這證實了反芻動物可以利用非蛋白質氮。同年 J. K. Looli 等人以脲當作唯一氮源餵食綿羊,發現綿羊能夠正氮平衡,表明綿羊瘤胃裡的微生物能利用脲合成其生長所需的10種必需氨基酸。自此,脲及尿素化合物成為反芻動物的飼料添加劑了。
脲是一種很好用的保濕成分,它就存在於肌膚的角質層當中,屬於肌膚天然保濕因子NMF的主要成分。對肌膚來說,尿素具有保濕以及柔軟角質的功效,所以也能夠防止角質層阻塞毛細孔,藉此改善粉刺的問題。用於面膜、護膚水、膏霜、護手霜等產品中保濕成份的添加。添加比例為3-5%。
脲對鋼鐵、不鏽鋼化學拋光有增光作用,在金屬酸洗中用作緩蝕劑,也用於鈀活化液的配製。
脲是紡織工業在染色和印刷時的重要輔助劑,能提高顏料可溶性,並使紡織品染色后保持一定的濕度。
方法名稱:尿素—尿素的測定—中和滴定法
應用範圍:本方法採用滴定法測定尿素中尿素的含量。
本方法適用於尿素。
方法原理:供試品照氮測定法測定,用鹽酸滴定液滴定,根據滴定液使用量,計算尿素的含量。
試劑: 1. 鹽酸滴定液(0.2mol/L)
儀器設備:
試樣製備: 1. 鹽酸滴定液(0.2mol/L)
配製:取鹽酸18.0mL,加水適量使成1000mL,搖勻,得0.2mol/L鹽酸滴定液。
標定:取在270~300℃乾燥至恆重的基準無水碳酸鈉約0.3g,精密稱定,加水50mL使溶解,加甲基紅-溴甲酚綠混合指示液10滴,用本液滴定至溶液由綠色轉變為紫紅色時,煮沸2分鐘,冷卻至室溫,繼續滴定至溶液由綠色變為暗紫色。每1mL鹽酸滴定液(0.2mol/L)相當於10.60mg的無水碳酸鈉。根據本液的消耗量與無水碳酸鈉的取用量,算出本液的濃度。
取0.1%甲基紅的乙醇溶液20mL,加0.2%溴甲酚綠的乙醇溶液30mL,搖勻。
操作步驟:精密稱取供試品約0.15g,置凱氏燒瓶中,加水25mL、3%硫酸銅溶液2mL與硫酸8mL,緩緩加熱至溶液呈澄明的綠色后,繼續加熱30分鐘,放冷,加水100mL,搖勻,沿瓶壁緩緩加20%氫氧化鈉溶液75mL,自成一液層,加鋅粒0.2g,用氮氣球將凱氏燒瓶與冷凝管連接,並將冷凝管的末端伸入盛有4%硼酸溶液50mL的500mL錐形瓶的液面下,輕輕擺動凱氏燒瓶,使溶液混合均勻,加熱蒸餾,俟氨餾盡,停止蒸餾,餾出液中加甲基紅指示液數滴,用鹽酸滴定液(0.2mol/L)滴定,並將滴定的結果用空白試驗校正。每1mL鹽酸滴定液(0.2mol/L)相當於6.006mg的CH4N2O。
註:“精密稱取”系指稱取重量應準確至所稱取重量的千分之一。“精密量取”系指量取體積的準確度應符合國家標準中對該體積移液管的精度要求。
避免與皮膚和眼睛接觸。