反義核酸
反義核酸
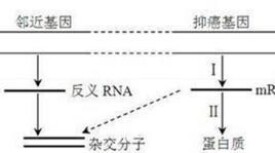
反義RNA是指與靶RNA(多為mRNA)具有互補序列的RNA分子,通過與靶RNA進行鹼基配對結合的方式。參與基因的表達調控。反義核酸是指能與特定mRNA精確互補、特異阻斷其翻譯的RNA或DNA分子。利用反義核酸特異地封閉某些基因表達,使之低表達或不表達,這種技術即為反義核酸技術1-3。它包括反義RNA、反義DNA和核酶(ribozymes)三大技術。反義核酶作為一種基因下向調節作用因子,在抑制一些有害基因的表達和失控基因的過度表達上發揮著重要作用。隨著反義核酶技術的發展和成熟,已逐漸應用於抗某些人體寄生蟲病的研究。
反義核酸目前有三種來源:一是利用固相亞磷醯胺法人工合成的短小反義寡聚核苷酸(antisense oligodeoxyncleotides,AON),這是反義核酸最普遍的應用方式,包括未修飾AON和硫代磷酸酯化(PS)、磷酸二酯化(PO)和甲基化等修飾AON二類,其中以PSAON應用最廣泛。ANO設計合成簡單,只要其順序與靶mRNA部分順序互補即可,而對基因的讀碼框無要求;二是更具有實用價值的人工表達載體,包括單個基因和多個基因的聯合反義表達載體,它是利用基因重組技術將靶基因序列反向插入到載體的啟動子和終止子之間,通過轉錄可源源不斷產生反義RNA分子;三是天然存在的反義核酸分子,但目前分離純化尚存在困難。
反義RNA是指能和mRNA完全互補的一段小分子RNA或寡聚核苷酸片段,反義DNA是指能與基因DNA雙鏈中的有義鏈互補結合的短小DNA分子。反義RNA和反義DNA主要是通過mRNA的翻譯和基因DNA的轉錄而發揮作用:1)抑制翻譯。反義核酸一方面通過與靶mRNA結合形成空間位阻效應,阻止核糖體與mRNA結合,另一方面其與mRNA結合后激活內源性RNase或ribozyme,降解mRNA;2)抑制轉錄。反義DNA與基因DNA雙螺旋的調控區特異結合形成DNA三聚體(triplex),或與DNA編碼區結合,終止正在轉錄的mRNA鏈延長。此外,反義核酸還可抑制轉錄后mRNA的加工修飾,如5'端加帽、3'端加尾(poly a)、中間剪接和內部鹼基甲基化等,並阻止成熟mRNA由細胞核向細胞漿內運輸。
Cech等發現四膜蟲核糖體RNA前體在成熟過程中,可精確地自我切除某些片段並重新連接,這種具有酶催化活性的RNA稱之為核酶[11,12]。
核酶廣泛存在於生物細胞中,有鎚頭狀和髮夾二種結構。酶活性中心由兩個臂和中間的功能區組成。兩個臂序列高度保守,與靶RNA特異互補結合,相當於一種反義RNA,而功能區則可通過降解RNA的磷酸二酯鍵而分解消化靶RNA,而核酶本身在作用過程中並不消耗。核酶裂解分子依賴嚴格的空間結構形成,裂解部位總是位於靶RNA分子中GUX三聯體(X:C、U、A)下遊方向即3'端。
核酶除天然存在外,也可人工合成。根據核酶的作用位點、靶mRNA周圍的序列和核酶本身高度保守序列,可方便地人工設計合成核酶的特異性序列。此外,利用基因工程將核酶的編碼基因克隆在SP6或T7等啟動子下游,通過轉錄合所需核酶。核酶能特異切割RNAA分子,使阻斷基因表達,特別是阻斷有害基因的表達成為可能。如果已知靶mRNA中GUX三聯體的位置,可將核酶的編碼基因插入反義表達載體的適當位置,這樣轉錄所產生的含有核酶的反義RNA具有雙重功能:一方面具有反義抑制作用,另一方面具有切割靶mRNA的催化作用。核酶在抗腫瘤、抗病毒方面具有十分誘人的前景,第一個應用核酶進行艾滋病基因治療的臨床計劃已獲准,核酶作為一種遺傳信息藥物,在腫瘤基因治療中必將日益受到重視。
反義核酸作為基因治療藥物之一,與傳統藥物相比具有諸多優點。1)高度特異性:反義核酸藥物通過特異的鹼基互補配對作用於靶RNA或DNA,猶如“生物導彈”。2)高生物活性、豐富的信息量;反義核酸是一種攜帶特定遺傳信息的信息體,鹼基排列順序可千變萬化,不可窮盡。3)高效性:直接阻止疾病基因的轉錄和翻譯。4)最優化的藥物設計:反義核酸技術從本質上是應用基因的天然順序信息,實際上是最合理的藥物設計。5)低毒、安全:反義核酸尚未發現其有顯著毒性,儘管其在生物體內的存留時間有長有短,但最終都將被降解消除,這避免了如轉基因療法中外源基因整合到宿主染色體上的危險性。
反義核酸技術的飛速發展和成熟,使其逐漸滲透並應用到寄生蟲學領域,豐富和發展了寄生蟲病的基因治療策略。反義核酸技術在抗寄生蟲病研究的應用主要集中於原蟲類,如瘧原蟲、錐蟲和利什曼原蟲等,而且反義核酸中又以AON方面的報道最多。下面著重就AON在寄生蟲方面的研究應用作用一簡要闡述。
⒊1 瘧原蟲
瘧原蟲嘌呤核苷酸合成具有特殊性,即無從頭合成途徑,依靠補救合成途徑利用體內遊離的嘌呤或嘌呤核苷。瘧原蟲的二氫葉酸還原酶(dihydrofolate reductase,DHFR)和胸苷酸合酶(thymidylate synthase,TS)結合形成雙功能蛋白(DHFR-TS),這對於維持瘧原蟲四氫葉酸水平和DNA合成極為重要,此酶也是瘧原蟲脫氧胸苷酸生物合成唯一通路中必不可少的酶。抗瘧葯中的抗葉酸代謝葯如乙胺嘧啶,就是通過競爭性抑制DHFR-TS來阻斷蟲體脫氧胸苷酸生物合成。然而,隨著惡性瘧原蟲(Plasmodium falciparum)多葯抗性株的出現和廣為傳播,瘧疾的化療面臨重大挑戰,促使人們尋求新的抗瘧療法。目前,DHFR-TS是AON抗瘧作用首選靶基因。
生物大分子進入感染紅細胞中的瘧原蟲,必需穿透三層膜,即紅細胞膜、納蟲泡膜和蟲體的胞質膜。研究表明,不能穿透紅細胞膜和納蟲泡膜的大分子和葡聚糖、IgG2a抗體和蛋白A等,可經過納蟲微管(parasitophorous duct)進入蟲體,蟲體通過胞吞作用直接從細胞外攝入大分子物質。因此,對於小分子的AON而言,作用於感染紅細胞中的蟲體完全成為可能,下述眾多研究已充分證明了這一點。Rapaport等(1992)研究發現,以DHFR-TS為靶21 nt PS AON能選擇性地進入惡性瘧原蟲感染紅細胞,對體外培養的氯喹敏感株和耐葯株蟲體具有同等的抑制效果,而未感染瘧原蟲的紅細胞則完全為不攝入AON,因此這對應用反義核酸於抗瘧治療非常有利。
諸多研究表明,AON越長,對轉譯的抑制作用就越強;AON濃度越高,非特異性抑制作用越明顯,在低濃度時則呈特異性抑制。Sartorius和Franklin(1991)以DHFR-TS的mRNA為靶合成系列AON,利用兔網織紅細胞翻譯系統,探討AON對體外轉譯的抑制作用。在DHFR翻譯起始位點處合成了6條21-49nt不等長的AON,在TS編碼區全成的30nt、39nt和49nt三條AON。當AON長度為30nt或更長時,呈明顯轉譯抑制作用,抑制率可高達50%以上。其中,TS編碼區的49nt aON(OTS49)抑制效果最高,當濃度在45μmlo/L時的抑制率幾乎達90%,主要是因為OTS49與DHFR-TS靶mRNA