可溶性鹼
可溶性鹼
根據鹼在水中的溶解性不同,可分為可溶性鹼和不溶性鹼。在常見的鹼中,氫氧化鈉、氫氧化鉀、氫氧化鋇、氨水(主要成分)等屬於可溶性鹼
其他可溶性鹼有:氫氧化鍶[Sr(OH)2]、氫氧化銣(RbOH),氫氧化銫(CsOH),氫氧化亞鉈(TlOH·H2O),氫氧化鋰(LiOH)氫氧化鐳[Ra(OH)2]
其他屬於不溶性鹼,如氫氧化鎂、氫氧化銅、氫氧化鐵等。
俗稱火鹼、燒鹼、苛性鈉。氫氧化鈉的用途十分廣泛,在化學實驗中,
除了用做試劑以外,由於它有很強的吸濕性,還可用做鹼性乾燥劑。燒鹼在國民經濟中有廣泛應用,許多工業部門都需要燒鹼。使用燒鹼最多的部門是化學藥品的製造,其次是造紙、煉鋁、煉鎢、人造絲、人造棉和肥皂製造業。
性狀
熔融白色顆粒或條狀,現常製成小片狀。易吸收空氣中的水分和二氧化碳。1g溶於0.9ml冷水、0.3ml沸水、7.2ml無水乙醇、4.2ml甲醇,溶於甘油。溶於水、乙醇時或溶液與酸混合時產生劇熱。溶液呈強鹼性。相對密度2.13。熔點318℃。沸點1390℃。半數致死量(小鼠,腹腔)40mg/kg。有腐蝕性。其水溶液有澀味和滑膩感。氫氧化鈉對二氧化碳有吸收作用,也是生物實驗常用的化學品。儲存
密封乾燥保存。容器蓋用膠皮蓋.
化學性質
NaOH + HCl → NaCl + H2O 另外,於許多的有機反應中,氫氧化鈉也扮演著催化劑的角色,其中,最具代表性的莫過於酯化反應,又名皂化反應:
RCOOR' + NaOH → RCOONa + R'OH 之所以氫氧化鈉於空氣中容易變質,是因為空氣中含有二氧化碳:
2NaOH + CO2 → Na2CO3 + H2O 倘若持續通入過量的二氧化碳,則會生成碳酸氫鈉,俗稱為小蘇打,反應方程式如下所示:
Na2CO3 + CO2 → 2NaHCO3+ H2O氫氧化鈉腐蝕性極高,就連玻璃製品也無法倖免於難,兩者會生成硅酸鈉〈sodium silicate〉,使得玻璃儀器中的活塞黏著於儀器上,無法再次使用之。如果以玻璃容器長時間盛裝熱的氫氧化鈉溶液,會造成玻璃容器損壞,甚至破裂的情況。
兩性金屬會與氫氧化鈉反應生成氫氣,1986年,英國有一油罐車誤裝載重量百分率濃度為25%的氫氧化鈉水溶液,氫氧化鈉便與油罐壁上的鋁產生化學變化,導致油罐因內部壓力過載而永久受損,反應方程式如下所示:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑氫氧化鋁為一相當常用於除去水中雜質的膠狀凝聚劑,因過渡金屬的氫氧化物大都不太溶於水,故於自來水中添加明礬可促使過渡金屬以氫氧化物的形式沉澱析出,再利用簡單的過濾設備,即可完成自來水的初步過濾。明礬的製備也牽涉到氫氧化鈉的使用:
2Al2(SO4)3 + 2NaOH + 2H2O → 2Al(OH)3 + 3H2↑
用途
廣泛應用的污水處理劑、基本分析試劑、配製分析用標準鹼液、少量二氧化碳和水分的吸收劑、酸的中和鈉鹽製造。製造其它含氫氧根離子的試劑;在造紙、印染、廢水處理、電鍍、化工鑽探方面均有重要用途;國內品牌有:天惠牌、天工牌、金達牌。
氫氧化鈉還是許多有機反應的良好催化劑。其中最典型的是酯的水解反應:RCOOR' + NaOH → RCOONa + R'OH

氫氧化鈣
產品用途
建築:三合土、石灰漿.刷牆壁(Ca(OH)2+CO2=CaCO3↓+H2O)
注意:1.二氧化碳使澄清石灰水變渾濁
⒉新刷的牆壁會“出汗”
⒊盛放石灰水的瓶子打開時間久了,會形成一層白膜(碳酸鈣),可以用鹽酸清洗
農業:配製波爾多液作為農藥(Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓硫酸鈣微溶於水)
{注意:配製時,不能在鐵制的容器中進行,也不能用鐵棒進行攪拌(Fe+CuSO4=Cu+FeSO4)
改變土壤的酸鹼性將適量的熟石灰加入土壤,可以中和酸性,改變土壤的酸鹼性
工業:制氫氧化鈉(亦稱火鹼、燒鹼、苛性鈉)(Ca(OH)2+Na2CO3=CaCO3↓+2NaOH)、
配製價格低廉的漂白粉(2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O)
腐蝕性防護
其粉塵或懸浮液滴對粘膜有刺激作用,雖然程度上不如氫氧化鈉重,但也能引起噴嚏和咳嗽,和鹼一樣能使脂肪乳化,從皮膚吸收水分、溶解蛋白質、刺激及腐蝕組織。吸入石灰粉塵可能引起肺炎。最高容許濃度為5mg/m3。吸入粉塵時,可吸入水蒸氣、可待因及猶奧寧,在胸廓處塗芥末膏;當落入眼內時,可用流水儘快沖洗,再用5%氯化銨溶液或0.01%CaNa-EDTA溶液沖洗,然後將0.5%地卡因溶液滴入。工作時應注意保護呼吸器官,穿戴用防塵纖維制的工作服、手套、密閉防塵眼鏡,並塗含油脂的軟膏,以防止粉塵吸入。化學性質
氫氧化鈣能與指示劑作用,使紫色石蕊試液變藍,使無色酚酞試液變紅。
氫氧化鈣能與某些非金屬氧化物反應,生成鹽和水。
氫氧化鈣能跟某些酸反應,生成鹽和水。
氫氧化鈣能和某些鹽反應,生成另一種鹼和另一種鹽。

氫氧化銅
是一種苛性鹼,固體為白色晶體粉末或小顆粒,屬四方晶系晶體。相對密度為1.46g/cm3,熔點為471℃,沸點925℃,於沸點開始分解,在1626℃完全分解。它微溶於乙醇,可溶於甲醇,不溶於醚;因溶解放熱和溶解后溶液密度變大的緣故,在288K飽和水溶液濃度可達5.3mol/L。可認為是強鹼:Kb=0.675,pK=0.17。一水合物屬單斜晶系晶體,溶解度:22.3g/100g水(10℃),密度為1.51g/cm3。呈強鹼性,因而其飽和溶液可使酚酞改變結構,能使酚酞由無色轉變為深紅色。在空氣中極易吸收二氧化碳.氫氧化鋰有強的腐蝕性及刺激性,應密封保存。
Ba(OH)2(可溶於水)=====600℃======BaO+H2O
鹼的分解(鹼=加熱=金屬氧化物+水)
不溶性鹼也具有能跟酸發生中和反應,生成鹽和水的性質。
以上可溶性鹼與不溶性鹼的某些性質上的差異,說明各種金屬陽離子對氫氧根離子的影響不同。
可溶性碳酸鹽的性質:與酸反應生成新鹽 水和二氧化碳; 與某些鹼或鹽生成難溶的碳酸鹽
不溶性碳酸鹽的性質可以從CaCO3的性質推
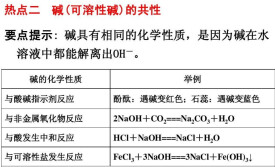
可溶性鹼,不溶性鹼都具有鹼的通性(不溶性鹼也可以微弱地溶於水,在水中溶解度很小,使某些鹼的通性表現不明顯,如有的不能使酸鹼指示劑變色、不能跟鹽發生複分解反應等。):
1、鹼溶液能與酸鹼指示劑作用
鹼溶液遇紫色石蕊試液變藍(現象不明顯,但有變化),遇無色酚酞溶液變紅(現象明顯)
2、鹼能與非金屬單質發生反應
鹵素與鹼的歧化反應,如:
Cl2+2NaOH=NaCl+NaClO+H2O(Br2、I2類似)
硫與鹼的歧化反應,如:
3S+6NaOH=NaSO3+2Na2S+3H2O
硅與鹼的反應,如:
Si+2NaOH+H2O=Na2SiO3+2H2↑
3、鹼能與酸發生反應,生成鹽和水(這類反應通常被稱作中和反應,此類反應放出大量熱)
舉例:工業上常用熟石灰(氫氧化鈣)中和含過多硫酸的廢水
Ca(OH)2+H2SO4=CaSO4+2H2O
4、鹼溶液能與非金屬氧化物反應,生成鹽和水
舉例:這類反應最常見的就是實驗室里用澄清石灰水檢驗二氧化碳的反應,但這類反應不屬於複分解反應
CO2+H2O==H2CO3
H2CO3+Ca(OH)2==CaCO3↓+2H2O
5、鹼溶液能與鹽反應,生成新鹼和新鹽
舉例:這類反應常見的有實驗室里製備氫氧化鈉的反應,鹼與鹽的反應有兩個要求,其一要求參與反應的鹼與鹽都要可溶於水,其二要求生成物中有沉澱、氣體或水生成。
某些鹼性氧化物與水反應生成相應的氫氧化物(可溶),這是物質的特有屬性