同芳香性
同芳香性
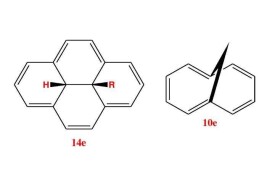
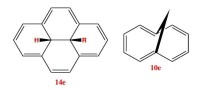
同芳香性:是指含有一個或多個sp雜化碳原子位於非定域平面外邊的體系。這種相隔一個飽和碳原子的非鄰接的sp雜化碳原子上的π軌道之間也可以發生有效的重疊,形成同共軛作用。如果所構成的同共軛體系具有4n+2個π電子,並呈現環狀平面結構,那麼它應具有芳香性,這種芳香性稱同芳香性。
例如,環辛三烯基正離子和雙環[3.2.1]-2,6-辛二烯基負離子都是同芳香性化合物。
同芳香性
同芳香性
1.特點分子的分析
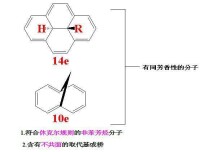
從休克爾規則我們可以得知,具有芳香性的通常是具有如下四個特點的分子:
(1)它們是包括若干數目π鍵的環狀體系;
(2)它們具有平面結構,或至少非常接近平面(平面扭轉不大於0.1nm);
(3)環上的每一個原子必須是sp2雜化(某些情況也可以是sp雜化);
(4)環上的π電子能夠發生離域。
2.分子具有芳香性的標誌
分子具有芳香性的標誌是:
(1)這類化合物雖有不飽和鍵,但不易進行加成反應,而與苯相似,容易進行親電取代;
(2)通過氫化熱或燃燒熱對離域能的熱化學測量表明,這類具有芳香性的環狀分子比相應的非環體系具有低的氫化熱低的燃燒熱,而顯示特殊的穩定性。
具有芳香性原因:
為什麼4n+2個π電子平面單環共軛體系才具有芳香性呢?從分子軌道能級計算髮現,當平面單環體系中的成鍵軌道數目為2 n+1時,如果有4n+2個π電子剛好能給滿成鍵軌道,從而具有類似惰性氣體的電子排布,而將具有最大的成鍵能而變得穩定,平面或接近平面,電子的離域才有效;當環上的原子存在空間的排斥作用而破壞環的平面時,4n+2規則不適用。
在單環共軛多烯分子中,π電子數目符合4n+2規則具有芳香性的原因,可以這種體系的分子軌道能級圖得到答案。在單環共軛多烯體系的分子軌道能級圖中,都有能量最低的成鍵軌道和能量最高的反鍵軌道。對於能量最高的反鍵軌道,在p軌道是單數時有兩個(簡併軌道);在p軌道是雙數時,只有一個。其它那些能量較高的成鍵軌道和反鍵軌道或/和非鍵軌道都是兩個(簡併的)。根據休克爾理論,當成鍵軌道充滿電子時,它們具有與惰性氣體相似的結構,因此體系趨向穩定,除能量最低的成鍵軌道需要2個電子充滿外,其它能量較高的兩個成鍵軌道和非鍵軌道需要4個電子才能充滿,即只有(4n+2)個π電子才能充滿這些軌道,使體系處於穩定,而具有芳香性。
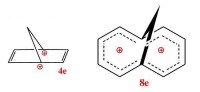
反芳香性:是指共平面,π電子數為4n,共面的原子均為sp或sp雜化的輪烯上,帶有不與輪烯共平面的取代基或橋。同芳結構的物質得到或失去電子成為4n體系是很難的,因為要生成更不穩定的反同芳結構。
同芳香性