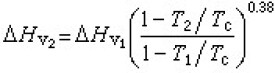熱化學數據
熱化學數據
熱化學數據(thermochemical data)是指與物理和化學變化的熱效應有關的基礎數據。
指沒有相變化和化學變化時,一定量均相物質溫度升高1K所需的熱量。如果是物質,則所需熱量即為摩爾熱容。在等壓條件下的摩爾熱容Cp,稱為定壓摩爾熱容。在等容條件下的摩爾熱容Cv,稱為定容摩爾熱容。通常將定壓摩爾熱容與溫度的關係,關聯成多項式。多項式中的係數,與物性、相態及溫度範圍有關,刊在有關手冊之中。
指物質在相變化過程中吸收或釋放的熱量,主要有:①蒸發熱,由液相變為汽相時的相變熱;②熔化熱,由固相變為液相時的相變熱;③升華熱,由固相直接變為汽相時的相變熱。在化工中,蒸發熱最常用。
確定相變熱常用的方法有兩種:①直接量熱。例如在等壓(壓力等於飽和蒸氣壓)下測定一定量液體蒸發所需的能量,算出蒸發熱。②先測量不同溫度下的飽和蒸氣壓,然後用克勞修斯-克拉珀龍方程(見蒸氣壓方程)計算蒸發熱。許多物質的相變熱數據刊在有關手冊中,也可用經驗式計算。其中蒸發熱數據已較完備,經驗式的精度也較高。
計算蒸發熱常用里德爾式:
式中為正常沸點下的蒸發熱;R為摩爾氣體常數;分別為正常沸點溫度和臨界溫度;pc為臨界壓力。此式預測誤差不大於。計算蒸發熱還常用沃森式:式中下標1和2分別表示兩個不同溫度。此式用於從某一溫度下的蒸發熱計算另一溫度下的蒸發熱。
熔化熱不但取決於溫度,還同固相的晶形有關,因而缺乏通用的計算方法。對於單原子物質,可用下式估算:
升華熱一般可以看作是熔化熱與蒸發熱之和。
化學反應熱 簡稱反應熱,是等溫下化學反應釋放或吸收的熱量。反應熱原則上可用兩種實驗方法測定:①用量熱計直接測量,例如使反應在絕熱的密閉容器中進行,通過能量衡算便可算出反應熱;②先測定不同溫度下的反應平衡常數,然後用關聯反應熱、反應平衡常數和溫度的熱力學公式計算反應熱。對於難以控制和測定其反應熱或平衡常數的化學反應,可根據1840年Γ.И.蓋斯所提出的蓋斯定律(化學反應或物理變化的熱效應與其途徑無關),利用生成熱(恆溫時由最穩定的單質化合成1摩爾某種化合物時焓的變化)或燃燒熱(1摩爾某物質完全燃燒時焓的變化)間接計算。具體計算式如下:式中分別為反應熱、i物質的生成熱和i物質的燃燒熱;上標“°”表示與反應有關的物質均處於熱化學標準態(氣體是壓力為的理想氣體狀態,液體和固體是壓力為的純液體和純固體),vi為反應方程中i物質的計量係數,i為反應物時其值為負,為產物時其值為正(見化學計量學)。許多物質的燃燒熱和生成熱數據刊在有關手冊中。
不同物質在恆溫、恆壓下混合時吸收或釋放的熱量。理想氣體混合時不產生混合熱。低壓氣體的混合熱很小,可忽略不計。某些結構相近的液體(如甲苯和苯),混合熱也很小。對於高壓氣體和結構差別大的液體,混合熱就須考慮。混合過程有時和反應過程相似,兩者間很難嚴格區分,例如鹽酸水溶液和氫氧化鈉水溶液的混合熱,實際上是氫離子與氫氧根離子化合成水的反應熱。氣體、液體和固體溶於溶劑中形成溶液時的混合熱,通稱溶解熱。溶解熱數據主要有四種類型:①積分溶解熱,即1摩爾溶質溶解於一定量溶劑中,形成一定濃度的溶液所吸收或釋放的熱量;②微分溶解熱,即1 摩爾溶質溶於大量一定濃度的溶液中而不改變溶液濃度時所產生的熱效應;③積分稀釋熱,為含有1摩爾溶質的溶液,從某一濃度稀釋至另一濃度時的熱效應;④微分稀釋熱,指在大量一定濃度的溶液中,不改變溶液濃度時,每加入1摩爾溶劑所產生的熱效應。