共找到4條詞條名為psp的結果 展開
- 日本SONY公司開發的多功能掌機系列
- 麻痹性貝毒的英文縮寫
- 程序段前綴的英文縮寫
- psp1.5豪華版
psp
麻痹性貝毒的英文縮寫
麻痹性貝毒(paralytic shellfish poisoning,簡稱PSP)是一種神經毒素,因人們誤食了含有此類毒素的貝類而產生麻痹性中毒的現象,所以稱之為麻痹性貝毒。其毒理與河豚毒素(TTX)相似,主要是通過對鈉離子通道的影響而抑制神經的傳導。麻痹性貝毒在許多種不同的貝毒中毒事件屬最嚴重,因其強烈毒性,經常造成消費者中毒死亡事件,並且具有廣布性與高發性。
貝類中PSP含量均值變化
麻痹性貝毒是一類四氫嘌呤的三環化合物,已發現的毒素根據取代基的不同進行分類C11上存在同分異構現象,在貝類體內,β異構體可以轉化成更加穩定的α異構體,其摩爾比(α/β)可以用來分析貝類的染毒時間。根據基團的相似性,麻痹性貝毒可分為四類:氨基甲酸酯類毒素(Carbamate toxins),包括石房蛤毒素(Saxitoxin,STX),新石房蛤毒素(Neosaxitoxin,NEO),膝溝藻毒素(Gonyautoxin),包括膝溝藻毒素GTX1,GTX2,GTX3和GTX4;N-磺醯氨甲醯基類毒素(N-sulfocarbamoyl toxins),包括C1、C2、C3、C4、GTX5(B1)和GTX6(B2);脫氨甲醯基類毒素(Decarbamoyltoxins),包括Decarbamoyl saxitoxin(dcSTX),Decarbamoyl neosaxitoxin(dcneoSTX),Decarbamoylgonyautoxins1-4(dcGTX1-4);脫氧脫氨甲醯基類毒素(Deoxydecarbamoyl toxins)。關於PSP的研究主要集中在對石房蛤毒素的研究上。

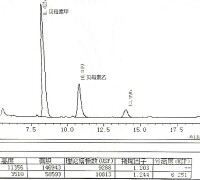
麻痹性貝毒標準品HPLC譜
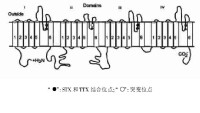
鈉通道α亞基結構
小白鼠PSP染毒病理照片
PSP 食物中毒很難診斷,一般診斷主要是依據進食史,即發病前攝入過可能含有PSP 的水產品,臨床癥狀是以神經系統和神經機能支配紊亂為主要癥狀,以及有很明顯的心臟血管的表現等綜合判斷,並且需要與抗膽鹼酯酶(如毒扁豆鹼)殺蟲劑中毒、河豚魚中毒等進行鑒別。沒有特效的實驗室檢測方法來協助診斷,然而,可以收集中毒水產品的捕撈地水樣檢測有毒雙鞭甲藻及對可疑食物PSP 定量定性檢測來確定是否為麻痹性貝類中毒。中毒早期可皮下注射鹽酸阿朴嗎啡5mg引吐,或洗胃后灌入2%碳酸氫鈉1L,口服活性碳吸附劑使毒素被吸附排出。對肌肉麻痹者可在急性期后給予士的寧2~3mg皮下或肌肉注射。一旦發現呼吸困難,必須立即實行人工呼吸、氣管插管或機械呼吸,及時供氧。對PSP毒素中毒尚無特效解毒藥。
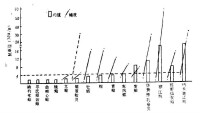
扇貝消化腺PSP含量變化
扇貝腸腺中PSP提取流程
Shimizu 等通過在培養產毒藍藻時,餵養穩定同位素13C和15N 標記的小分子有機物,培養后提純毒素進行核磁共振分析,發現是由乙酸(acetate)、精氨酸(arginine)、腺苷甲硫氨酸(S-adenosylmethionine)以及其他未知的化合物通過一條未知的途徑先合成石房蛤毒素,后或再經過其他修飾酶的作用轉化為其他種類的麻痹性貝毒。Shimizu 等還提出了一個可能的關鍵步驟:一個乙酸單元或衍生物與精氨酸或其前體在α碳上的CLAISEN 聚合。這個步驟完善了Chevolot提出的精氨酸前體理論,使精氨酸或其前體的結構可以完整地合併入毒素分子中,同時符合試驗的觀測結果。Shimizu 等研究發現了毒素分子環狀結構中所有碳分子的來源。Kellmann 等對產毒藍藻Cylindrospermopsis raciborskii T3 提取蛋白進行體外試管試驗,發現石房蛤毒素的生物合成前體是乙酸、精氨酸、腺苷甲硫氨酸、氨基甲醯磷酸(carbamoyl phosphate),參與合成的酶都來自於細胞質組分,同時試驗中所需的一種未知的輔酶,可以使用極性溶液從膜組分中提取到。在此基礎上,Moustafa 等利用sxt 基因簇(含26個推定的基因)作為模板或“餌”,通過全基因組測序、16S rRNA 分析、RAST 快速標註、發生樹分析等技術,研究在產毒藍藻(STX +)、不產毒藍藻(STX-)和其他非藍藻產毒生物如細菌、甲藻之間的同源和進化關係。結果發現,26個目標基因中有17個的起源是來自藍藻自身,這17個中有4個(Group I)屬於STX +和STX-所共有,另外13個只存在於STX + 中,這13個基因包括O-carbamoyltransferase、Sulfotransferase、Acyl-CoAN-acyltransferase、Saxitoxin-binding protein等;還有9個基因屬於非藍藻起源,其中5個起源於變形細菌(Proteobacteria),它們包括Cytidine deaminase、Amidinotransferase、Phytanoyl-CoA dioxygenase、Chaperone-likeprotein和1個未知基因;而關鍵的sxtA基因,BLAST 搜索發現其有2 個起源,前面的800 個氨基酸序列與Myxococcus xanthus(一種δ-變形細菌)的Polyketide synthase 基因是同源的,后390 個氨基酸序列與Frankia sp.(一种放線細菌)的classI&IIaminotransferase 基因是相似的。STX+的某個祖先獲取這些基因的方式為水平基因傳遞(horizontal gene transfer,HGT)和基因融合。藍藻和甲藻都有部分種可產生石房蛤毒素,但在進化上它們屬於多源起源。石房蛤毒素的生物合成機製為何會獨立地發生於2 個不同的類群,一種假設是甲藻從藍藻或其他細菌處通過HGT 或其他方式獲得這些基因,另一種假設是甲藻體內的細菌共生體是石房蛤毒素的主要貢獻者。這可能是未來該領域學者研究的一個重要方向。
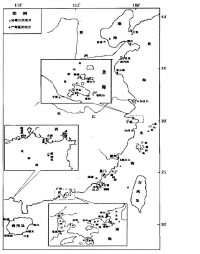
中國沿海PSP毒素分佈

蝦夷扇貝PSP含量變化
在中國南方海域PSP毒素研究中,不同地域間毒素的組成和含量雖有差別,但大體上比較相似,廣東沿海PSP毒素主要成分為低毒力的GTX5、C1和C2,高毒力的GTX1~4也佔一定比例,STX類毒素很低,在深圳大亞灣的有毒貝類中,α型毒素都多於β型毒素,α/β介於1.6~4.4之間。在廣東沿海的120個檢測的樣品中,只有13個被檢測出含有PSP毒性數據,檢出率為10.8%;PSP毒性範圍為152~198 MU·(100 g)-1。其中北津港(東平)的托氏毛蚶和神泉港(神泉)的近江牡蠣樣品中的PSP毒性,在1 h內致小白鼠的死亡率非常高,但毒性並不強,檢測出的毒性量值大大低於中國暫定的警戒標準[對KM系小白鼠而言,約423 MU·(100 g)-1]。 20世紀90年代春季廣東近岸海域PSP毒性的檢出率和毒性值均處於較高的水平。但自2003年以來廣東近岸海域的PSP毒性呈偏低狀況。國家海洋局南海環境監測中心在2003、2004年春季對南海區的多處地點和眾多樣品進行貝毒素檢測,大多出現檢不出貝毒素的情況,檢測出的貝毒素最高值也低於200 MU·(100 g)-1。而在北方,大連的蝦夷扇貝中PSP毒素成分也是以低毒力的C1和C2為主,佔60%以上,其次為GTX2和GTX3,STX和neoSTX含量最低,為5%左右;但未發現GTX5、GTX1和GTX4;在檢出的麻痹性貝毒組分中,α型毒素包括C1和GTX2,β型毒素包括C2和GTX3,α/β接近於1,表明扇貝累積麻痹性貝毒毒素的時間還較短。在黃海北部海域發現的麻痹性貝毒存在於蝦夷扇貝(Patinopecten yessoensis)體內,證實中國北方海域有麻痹性貝毒存在。有毒蝦夷扇貝樣品都出現在5月和6月,其中2003年6月25日檢出的貝毒毒性為445 MU/100 g,2005年5月25日檢出的貝毒毒性為419 MU/100 g,均已超出食用安全標準(400 MU/100 g)。值得關注的是,12個扇貝樣品中有9個直接采自大連附近海域;另外3個樣品購自青島,其中有2個檢出麻痹性貝毒毒性,其原產地也是大連。由此可以看出,染毒貝類的運輸和異地銷售有可能危及其它區域的消費者健康,同時也給毒素來源分析造成困難。蝦夷扇貝樣品檢出含有麻痹性貝毒的同期,在大連海域檢測的紫石房蛤、紫貽貝和櫛孔扇貝卻都沒有檢出麻痹性貝毒,研究期間大連海域表層海水中未發現毒赤潮生物,有毒赤潮生物可能以孢囊的形式沉於海底,通過蝦夷扇貝的濾食作用累積毒素。不同的亞歷山大藻藻種間毒素組成和毒性高低有很大差異,而即便對於同一藻種,來自不同海域的藻株之間毒素組成和毒性高低也有差別,毒素在貝類體內也會發生複雜的轉化。因此,僅參照國內有毒藻種的分析結果,很難確定貝類樣品中的毒素來源,有關蝦夷扇貝毒素來源還應做深入的研究。
有關赤潮毒素的毒性標準各國規定不一,分析方法也有差異。80%以上的國家和地區使用小白鼠生物分析法分析PSP毒性,僅荷蘭、丹麥及英國(蘇格蘭)規定同時使用HPLC(高效液相色譜)方法分析PSP毒性。警戒(安全)PSP毒性一般規定為80μg STXeq·(100 g)-1,即相當於400 MU·(100 g)-1,這在整個歐洲國家屬於政府規定標準。美國、日本、韓國和澳大利亞等國均採用這一標準,這一標準也是聯合國衛生組織和聯合國糧農組織規定及推薦的標準。菲律賓和挪威的PSP毒性警戒標準限制為40μg STXeq·(100 g)-1[相當於200 MU·(100 g)-1]。英國的北愛爾蘭則將PSP毒性警戒標準規定為32μg STXeq·(100 g)-1。依據上述情況,中國將PSP毒性的警戒標準暫定為80μg STXeq·(100 g)-1,即每100 g貝類軟組織中PSP毒性的STX當量值不得高於80μg[對KM系小白鼠而言,約423 MU·(100 g)-1]。檢測方法有小鼠生物測定法、電泳法、高效液相色譜法、液相色譜-串聯質譜法等。在這些檢測方法中小鼠生物法是最常用的方法。
小鼠生物法是利用麻痹性貝毒易溶於酸性溶液,酸性條件下熱穩定的性質,在pH值2~3,煮沸5 min提取麻痹性貝類毒素,對小鼠進行腹腔注射,小鼠產生特殊的抽搐麻痹癥狀並死亡,根據小鼠死亡時間,判斷毒性大小。該法易掌握,不需要使用專門儀器,但操作繁瑣,靈敏度不高,且在酸性環境中加熱有可能導致磺醯氨甲醯基類毒素轉變為相應的氨基甲酸酯類毒素,使毒性增大,而且花費高、重現性差、可比性低、需大量使用小鼠,不適合大規模的現場檢測。基於麻痹性貝毒特異結合鈉離子通道的特性,細胞毒性試驗也被用於麻痹性貝毒的檢測。基於抗原抗體反應原理的酶聯免疫吸附法(enzyme-linked immunosorbentassays,ELISA)具有方便迅速的優點,已有售商品化的酶聯免疫分析試劑盒。由於抗體可能存在交叉反應等缺陷,還不能取代小鼠生物法。
理化分析法是將毒素分子通過鹼性氧化成為熒光衍生物或有色生物后通過紫外或熒光檢測系統進行分析檢測。高效液相色譜法(HPLC)是最常用的理化分析法。HPLC法檢測不同PSP時採用不同的洗脫體系及洗脫方法,且衍生過程也不同。同小鼠生物檢測法相比HPLC具有檢測速度快、檢出限低、靈敏度高等諸多優點。但是需要根據小鼠生物測定法進行標定且缺乏PSP 分析的標準品是HPLC法的主要缺點。另外,影響HPLC法普遍推廣的另一個原因是PSP 類似物的毒性種類都是唯一的且類似物間易相互轉化,判斷樣品中的原始或潛在總毒性較困難。
20 世紀60 年代起科研人員開始研究應用免疫檢測技術檢測PSP;80年代末建立的酶聯免疫吸附技術和放射性免疫因交叉反應低,不能檢測所有的毒素而未能得到推廣。90年代初成功的建立了酶聯免疫吸附檢測技術。免疫化學技術應用於PSP 檢測主要以單克隆抗體(MAb)為基礎。國外學者嘗試製備PSPMAb 抗體及定量測定PSP,取得令人滿意的結果。PSP 為小分子物質,不具有免疫原性,需要將其連接到大分子載體上,使其成為完全抗原,再用來免疫動物。一般採用小劑量長周期免疫方案製備單克隆抗體。免疫化學檢測法檢出限低且干擾少,對樣品前處理要求較低、簡便、快速、特異、經濟,因此具有極高的推廣價值。但免疫技術檢測貝毒存在產生抗體的交叉反應、系列標準毒素的缺乏等問題,這些問題限制著該技術的深入應用。而且抗體往往只是針對某一種毒素所建立,對於其他貝毒常常表現出較低的交叉反應,不能檢測所有的貝毒等。
