基因導入
基因導入
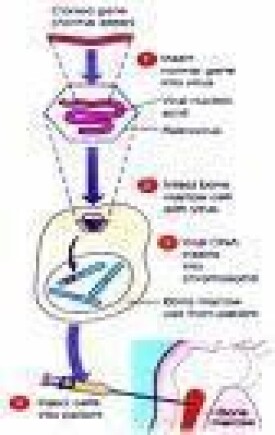
把已知基因轉移到真核細胞,並且整合到基因組中得到穩定表達的技術,稱為基因導入。它是改變物種遺傳性狀的最根本途徑。要把基因導入細胞,首先要把細胞克隆化。目前已經得到了若干真核細胞克隆化基因,如β-珠蛋白基因,TK基因等。利用顯微操作把這些基因注入到受體生物受精卵的原核中,再把受精卵植入到生殖管道中,發育成的個體不僅能表達注入基因決定的性狀,而且能把該基因傳到第二代。
這方面最成功的例子是“超級小鼠的誕生。這些小鼠生長快,74 d時的體重就接近同窩正常小鼠的兩倍。這一成果的意義不僅為遺傳工程和遺傳疾病(如巨人症)的研究提供了模型,而且也為加速經濟動物的生長提供了新的技術途徑。
1.1DNA直接注射法
:是目的基因導入的最簡單方法,但注入量有限,能夠接觸到的腫瘤細胞有限,故獲得的腫瘤細胞轉化率很低,多通過腫瘤局部多點注射給葯。
1.2顆粒轟擊技術
將目的基因包被金屬以後,利用高壓發射裝置,加速包裹目的基因的金屬顆粒進入細胞,從而提高腫瘤細胞的轉化率。
即用化學方法構建非病毒載體系統,借之完成基因轉導。主要包括以下兩種。
2.1脂質體載體
脂質體載體方法具有安全、簡單、低毒、無免疫原性等優點,適用於注射方法進行器官靶向性轉移並有一定的轉移效率。是除病毒載體轉移方法之外的另一種有價值的體內基因轉移方法。多用於體外轉化細胞,或通過瘤組織內注射進行體內轉化,並已有少數臨床應用的報告。目前常用的是陽離子脂質體(商品名為Lipofectin)。它可自發的與DNA形成複合物,保護外源DNA不被核酸酶降解,具有製備簡單、安全無毒、無免疫原性、重複性、對基因片段大小無限制且轉染操作方便等優點。由於它可與細胞膜直接融合而能有效地避免溶酶體破壞,故遠比傳統的脂質體效率高。缺點是靶向性有限。Nishikawa等從BALB/c小鼠的尾靜脈注射以熒光素酶基因為報告基因的質粒DNA-脂質體複合物,發現肺、肝、脾等器官組織中都有熒光素酶基因及其產物,持續表達超過3個月。常規脂質體易被網狀內皮系統(RES)細胞攝取,在巨噬細胞本身可成為靶細胞的部位,RES的這種親合性是有利的。Hasegawa等採用日本血凝病毒( hemagglutinating virus of Japan,HVJ)脂質體為載體,用HSV-tk/Gcv系統治療肝癌發現,在體外試驗中當Gcv的濃度100microg/ml時幾乎所有腫瘤均被殺死,甚至當轉導率只有20%時,也有1/3腫瘤被消滅。此方法重複應用效果更佳,且皮下注射未見明顯的炎症反應。
2.2受體介導法
利用肝細胞上富含轉移因子和糖蛋白受體的特點,人工合成多聚陽離子氨基酸,進而連接轉移因子(或糖蛋白)和目的基因構成複合物,通過與肝細胞表面的受體結合來實現目的基因的轉移。此法靶向性好,但受體介導的內吞小泡會被轉運到溶酶體,易被溶酶體降解而造成目的基因表達時間短暫,表達效率低下。利用氯哇抑制溶酶體酶或腺病毒與內吞小泡相融合而將其破壞釋放出外源DNA,可提高轉化效率。
主要通過構建病毒載體來完成。
構建簡單,裝載外源基因容量最大達8kb,整合入宿主細胞基因組而無病毒蛋白表達。但僅能感染分裂期細胞,體外製備滴度較低,且其隨機整合有引起“插入性突變”的可能。
3.2腺病毒(adenovirus,Adv)
為近年肝細胞肝癌基因治療中報告最多的一種病毒載體。體外製備滴度較大,裝載外源基因容量最大達35kb,不整合入宿主細胞基因組因而避免插入突變的危險,能感染分裂細胞和非分裂細胞。但易引起宿主免疫反應而使轉染效率下降,且大劑量靜脈給予可導致嚴重的肝臟炎症反應,因此通過全身給葯受到限制。Nagao等發現瘤內注射重組Adv后,目的基因可有效表達,但表達時間短暫,重複注射后表達效率降低且誘發體液和細胞免疫反應。
3.3單純皰疹病毒
單純皰疹病毒(herps simplex virus,HSV)對非分裂細胞有天然的親合力,裝載外源基因容量達30kb,體外製備滴度接近腺病毒。但構建時難以除去與裂解細胞有關的基因而對細胞毒性大。
3.4腺相關病毒
腺相關病毒(adeno-associated virus,AAV)在人類不引起任何病理性後果,它能感染非分裂S相細胞,還能將基因轉人非周期(noncyling)腫瘤細胞。AAV是一種缺陷前病毒,對人類無致病性。能用於運載外源性重組基因組,已應用於肝和肝癌細胞的治療基因轉移。
3.徠5其他病毒
痘苗病毒(vaccini virus)可以獨立在細胞之中複製和轉錄,並能以較強的方式表達多個腫瘤抗原。
桿狀病毒(bacul virus)能夠感染肝細胞和肝腫瘤細胞,並能增強肝細胞腫瘤壞死因子a(TNFa)、IL-1a、IL-lβ的表達。