化學生物學
化學生物學
化學生物學是研究生命過程中化學基礎的科學。疾病的發生髮展是致病因子對生命過程的干擾和破壞;藥物的防治是對病理過程的干預。化學生物學通過用化學的理論和方法研究生命現象、生命過程的化學基礎,通過探索干預和調整疾病發生髮展的途徑和機理,為新葯發現中提供必不可少的理論依據。

Schreiber博士

Schultz博士
在正向法中,目標生物學現象第一次被定義,然後引起被尋找現象的分子選擇自許多被應用的分子。被選擇的分子能被附到某些蛋白質上而且抑制/活化它們,引發重要的修飾,然後與分子相連的蛋白質被檢查並研究。下面是使用正向法發現和發展肌基質蛋白的例子。
首先,為了獲得足量得化合物以引發要得到的現象,通過組合化學的合成方法製得嘌呤文庫。多種化合物可與放射性研究引起的不同變異相比較。有關文庫合成及應用在其它章節有詳述。
已經分化的神經原細胞和肌肉細胞很少被增殖。因此,一旦受傷,細胞長不好,恢復很難。這項研究的最初目的是為了找到一種化合物來引起改變肌肉細胞分化,達到再生目的。分化的肌肉組織構成交織的管狀結構。幾百個嘌呤類化合物被在96孔圓片上植入潛伏肌肉組織中,找到了能夠分離相連接的組織的化合物。這種化合物自肌管(myotube)隔斷(severing)嘌呤(purine)命名為myoseverin(肌基質蛋白)。事實上,肌基質蛋白並不僅切斷肌管分離細胞,而且洗滌化合物並添加必需的養分以幫助增殖。更令人激動的是如果增殖的細胞開始分化,它們又造出肌管。換言之,如果這種化合物被注入組織,一部分肌肉細胞就可期望再度生長並增殖,因而產生新的肌肉組織。
雖然發現能夠誘導需要的現象的化合物是最重要的前步驟,對與化合物反應的目標蛋白質的細緻檢查然後理解其活性和角色才是真正的辛苦工作。如果需要的現象定義得好,是否存在活性化合物的研究結果可以在短時間內顯示。
在肌基質蛋白的例子中,當細胞結構迅速改變時,預計細胞結構的構建蛋白質受到進攻,可以使用帶有熒游標記的抗體觀察細胞圖像。然後是染色的肌球蛋白,它是體細胞的重要組成部分。綠色的是肌球蛋白,藍色的是核。
肌基質蛋白處理前後的差異是顯而易見的。在肌基質蛋白處理之前,細胞被統一連接,但是處理后,可以看到細胞相互分離。然而,是否肌球蛋白是目標蛋白質還不能確定。一些骨骼蛋白質是染色了的但是結果是相似的。可是,當使用微管蛋白使微管染色的時候,卻得到了有趣的數據。同樣,綠色是微管蛋白,藍色是核。
在被肌基質蛋白處理之前,與先前的照片類似,細胞與微管緊密相連,但是以肌基質蛋白處理過的細胞表現出破裂的微管。因此,一般猜測肌基質蛋白直接的或間接的攻擊微管蛋白或微管。微管是個管形結構,含有a,b微管蛋白組合,它參與了支持細胞結構和染色體運動。
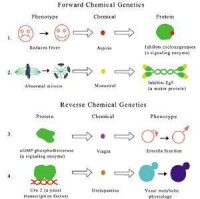
正向法和逆向法
根據以前的經驗,已證明微管蛋白在體外被肌基質蛋白進攻,但是在體內怎麼樣呢?為了尋找具有生物活性的分子與之成鍵的蛋白質,普通大小的固相樹脂被用於活性分子的親和力矩陣,然後蛋白質被釣出。肌基質蛋白上被加以連接分子,然後與固相樹脂相連做成釣索。然後浸入細胞質混合物一段時間,蛋白質與樹脂相連並被分析。然而,由於肌基質蛋白的活性和蛋白質合成現在被中止,這項工作不容易。這是化學生物學方法中眾所周知的問題。
在肌基質蛋白的例子中,如果不是使用連接分子與樹脂相連,叫做鏈霉抗生素蛋白(Streptavidin)的生物素與蛋白質強烈成鍵,一種強活性官能團的親核分子。這種方法的優點是引入了親和分子,簡單的將其插入活細胞內就可與目標蛋白質成鍵,而不是把細胞研碎而混合蛋白質。如果目標蛋白質與分子成鍵,化學活性基團將以共價鍵與蛋白質的親核部分結合,因而可以通過生物素使鏈霉抗生素蛋白體與目標蛋白質成鍵。已證明實驗后體內微管蛋白與親和分子成鍵。
綜上所述,由篩選系統發現的肌基質蛋白使得已分化的肌細胞再生成為可能,已證明微管蛋白引起了這種現象。與經典遺傳學相比,人們可以掌握出現的目標基因並甚至得到控制目標蛋白質活性的小分子開關。這種肌基質蛋白,在經過實驗后,可被用作新的藥物候選者。
綜述
在逆向法中,目標蛋白質受到化學物質進攻,首先被分類,然後可以通過觀察插入相關化學物時的結果作用來分析目標蛋白質的體外功能。這裡有一個這種方法的實例:purvalanol的發展和應用。
目標蛋白質
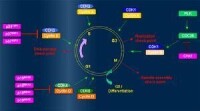
細胞周期和CDK
CDK的發展
以正向法製得的嘌呤文庫被用於在純凈的CDK1和CDK2上篩選酶抑製劑。之所以使用嘌呤是為了讓嘌呤類物質通過輔酶與ATP競爭結合位點。為了加速篩選過程,通過使用放射性標記的ATP和組蛋白在96圓片上使酶活化,然後測量磷酸基自用硝基纖維素濾紙過濾出的蛋白質轉移到組蛋白這過程中的所有的放射性。由olomocine起始,(IC507mM),幾步重複之後我們得到約1000倍活化的purvalanol系列化合物。這些化合物同等程度抑制CDK1和CDK2。這是因為兩種酶都是通過非常相似的路線建立起來的,它們的ATP結合位點也相似。
Purvalanol作用
如果CDK1和2被抑制,將有什麼發生呢?由於眾所周知的事實,這些酶在有絲分裂的每一步都扮演了重要角色,研究的第一步就是觀察對易於觀測有絲分裂的青蛙卵提取物的作用。在這個實驗中,注入激素以誘發更多排卵,從卵中提取出必要的物質。當植入從青蛙精子提取的DNA時,卵細胞誤識其為受精,並模仿細胞分裂。通過控制中期(metaphase)Ca的數量可以中止細胞分裂。卵細胞對這個實驗非常有用,因為它們含有大量的蛋白質。為了使圖片清晰,核DNA染成藍色而微管蛋白染成紅色。在正常階段,DNA摺疊以形成染色體並排成一行。然後微管連到其上將其分到兩邊。但是,如果在這個階段加入purvalanol,DNA不會完全摺疊,微管就找不到它們的連接位點。這應該是進攻了G2到M的步驟。可以說,對CDK1的抑制強於CDK2。另外,如果肌基質蛋白同時被加入,DNA一點也不摺疊,而且微管結構完全消失。這可能是G2階段后緊隨的M階段的微管受到進攻。
成鍵的確認

體內微管蛋白
另一方面,(A)和(B)柱吸附的蛋白質被過濾而且以陰離子洗滌劑十二烷基磺酸鈉(SDS)處理,然後通過聚丙烯醯胺凝膠電泳分離。兩柱都吸附的蛋白質被忽略,考慮到它們在柱子上隨機附著,或者通常與嘌呤結構成鍵,只有親合性柱吸附的蛋白質被證實是CDK1。
其它作用
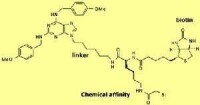
親和性的肌基質蛋白分子
儘管99%的人類基因組序列已經發現,還有1%的工作要做,下一步最重要的工作卻是找出基因的功能。從研究基因結構和表達入手來解釋物種特徵是遺傳學的工作。經典遺傳學在研究基因表達上有兩種方法;一種是正向法(forward approach)另一種是逆向法(reverse approach)。估計正向法的命名是由於先鋒遺傳學家們嘗試猜想究竟哪個基因對一個性狀產生影響並引用分子遺傳學來證實。而逆向法得名於採用不同的方法尋找DNA標記點和性狀之間的聯繫,無需知道疾病起因。
在正向法中從遺傳疾病患者或者由X光照射引起突變的基因中選擇出非正常性狀,然後尋找基因和性狀之間的聯繫。由於發現X光照射能引起突變,Hermann Joseph Muller獲得了1946年諾貝爾醫學及生理學獎。
基因可以通過敲除(Knockout)而刪除或者超量表達(Overexpression)而增加。在逆向法中採用了基因工程技術,通過分析改變特定基因而引起的性狀改變來發現基因的表達和活動。然而有時由於一些基因的活動被其他蛋白質刪除后的補償作用所替代,性狀改變難以觀測甚至被忽略掉。同時,由於性狀改變有可能是由於蛋白質異常活動的第二或第三重影響,雖然這種性狀改變可以觀測,慎重的確認過程仍是需要的。改性基因的誘導作用通常不斷積累,證據就是在足夠的觀察之前胚胎髮育並可能殺死該生物。如果基因在生長中有不同的作用,這種基因是不適合研究的。
因此有時觀察特徵修飾時特定基因表達被暫時抑制。這時,反義低聚物和能與mRNA反應並阻止蛋白質合成的RNAi被成功使用。
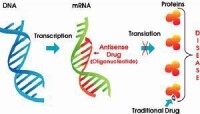
反義低聚物
RNAi(RNA介入)是一個雙鏈RNA,一鏈具有與目標mRNA相同的序列和強抑制作用。RNAi最早於1995年在C-elegans中的反義低聚物實驗時被偶然發現。一般發現義和反義混合物較反義本身表現出對為mRNA更強的抑制作用。進一步的研究證實不足量的雙鏈足以完全抑制,而且表現出對序列的特定倍增。也已知它不但抑制蛋白質合成,而且mRNA本身的量也在幾小時內減少。雖然精確的機理仍然不甚了解,但是對抗病毒或轉位子的天然防禦機制是其發生作用的一個模型。由於雙鏈RNA在我們體內不多,一旦被發現就被自我防禦機制視為異體,比如RNaseH。這樣的21-23mer的碎片被解鏈酶分為單鏈。單鏈將與mRNA結合,形成更多的雙鏈,這就進入了倍增循環。
化學生物學使用的大多數協議使用將小分子與天然蛋白質成鍵然後控制它們的方法。然而,當目標蛋白質在大的官能團中存在的時候,選擇性的控制每個蛋白質非常困難。激酶(Kinase)在體內是一種使用ATP作磷酸化蛋白質及其它底物的輔助因子的酶。蛋白質磷酸化,是重要的信號傳遞系統的開關,指導蛋白質結構的修飾。當生長因子或激素綁到一個細胞表面上的受體時,多種激酶逐漸活化,信號被傳輸。有時,一種激酶通過磷酸化活化另一種。因此,如果我們能將某個激酶磷酸化特定蛋白質的途徑做成譜圖,這將為解釋細胞與細胞表面受體結合后細胞內信號如何傳遞提供重要線索。一個研究方法是在存在以放射性標記磷酸基的ATP給出的信號同時,檢測蛋白質與放射性標記的P成的鍵。雖然如此,因為已經知道人體內存在數以千計的激酶,找出每種激酶的功能並不容易,因為它們有可能是逐步活化的,也可能是平行的。
微管蛋白(Tubulin)和微管(Microtubule)
另一方面,合成僅與遊離的修飾后的ATP成鍵的選擇性抑製劑不是很困難,可以在不影響其它激酶的條件下研究有關的激酶的抑制。這證明了從天然的蛋白質的經結構修飾得到的人造蛋白質,能通過人造ATP維持生物活性。這種方法代表了一個新的研究方向,不僅是蛋白質信號傳遞研究的,而且是整個生物學化學研究的。
化學生物學(代碼:070303)屬於理學大類,化學類。
化學生物學以生物無機化學、生物分析化學、生物有機化學、生物化學、化學信息學、生物物理化學和仿生高分子材料為研究方向、發展方向,培養具有良好的科學素質,掌握化學基礎理論、基本知識和基本技能,並得到應用研究、科技開發、科技管理初步訓練的專門人才。
化學生物學主要學習化學與生物科學的基本理論、基本知識和實驗、應用技能,受到基礎研究和應用基礎研究方面的科學思維和科學實驗訓練,具備應用研究、技術開發和科技管理的基本技能。
本專業主要培養具有堅實的化學與生物學基礎知識和較廣泛的化學生物學交叉領域的知識,具有熟練的化學與相關生物學實驗技能,創新意識強,綜合素質高,能在化學生物學、化學、生命、醫藥、材料、化工、環保等相關領域從事教學、科研、技術開發及管理工作的複合型應用人才。
通過學習,將具備了以下幾方面的能力:
1、掌握數學、物理、計算機等方面的基本理論與知識;
2、掌握無機化學、分析化學、有機化學、物理化學、普通生物學、遺傳學、微生物學、生物化學、細胞生物學等學科知識;
3、了解相近專業如化工與製藥、環境科學專業的一般原理和知識;
4、了解國家關於科學技術、化學生物相關產業、知識產權等方面的政策、法規;
5、了解化學生物學的理論前沿、應用前景、最新發展動態,以及化學生物學相關產業發展狀態;
6、掌握化學生物學領域中外文資料查詢、文獻檢索以及運用計算機等現代技術獲取相關信息的基本能力;
7、具有一定的實驗設計及創造實驗條件,歸納、整理、分析實驗結果,撰寫論文;
8、掌握一門外國語,具備較強的讀、寫、聽、說(“四會”)能力,參與學術交流的能力。
無機化學、分析化學、有機化學、物理化學、結構化學、生物無機化學、生物有機化學、儀器分析、高分子化學、細胞生物學、生物化學、分子生物學、生物信息學導論、化學生物學、化學工程基礎及化工製圖等。化學基礎實驗、生物化學實驗、化學生物學綜合實驗。
本專業的授課方式有三方面的特點,一是注重基礎,即專業基礎課程(包括理論課和實驗課);二是強化交叉,重視化學學科和生物學學科的交叉滲透,學習利用化學的理論、研究方法和手段來探索生物問題;三是加強實踐教學,有專業基礎課的相關實驗課,包括基礎化學實驗、普通生物學實驗、遺傳學基礎實驗、微生物學實驗、細胞生物學實驗、生物化學實驗,以及學習實踐,包括生產實習、畢業論文等,一般安排10一20周。
化學(070301)、應用化學(070302)、分子科學與工程(070304)。
蛋白質研究
清華大學(10003)、廈門大學(10384)、西北大學(10697)、西北農林科技大學(10712)、中山大學(10558)、南開大學(10055)、南京大學(10284)、北京大學(10001)、華南理工大學(10561)、安徽工業大學(10360)、天津師範大學(10065)、四川農業大學(10626)、中南民族大學(10524)、湖北大學(10512)、三峽大學(11075)、衡陽師範學院(10546)等。
