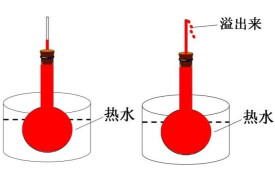
冷脹熱縮
應用於物理學科的現象
在一般情況下,當物體的溫度升高時,物體的體積膨脹、密度減小,反之亦然。也就是通常所講的“熱脹冷縮”現象。
冷脹熱縮
然而水在由0℃溫度升高時,出現了一種特殊的現象。人們通過實驗得到了ρ-t曲線,即水的密度隨溫度變化的曲線。在溫度由0℃上升到4℃的過程中,水的密度逐漸加大;溫度由4℃繼續上升的過程中,水的密度逐漸減小;水在4℃時的密度最大。水在0℃至4℃的範圍內,呈現出“冷脹熱縮”的現象,稱為反常膨脹。水的反常膨脹現象可以用氫鍵、締合水分子理論予以解釋。
物質的密度由物質內分子的平均間距決定。對於水來說,由於水中存在大量單個水分子,也存在多個水分子組合在一起的締合水分子,而水分子締合后形成的締合水分子的分子平均間距變大,所以水的密度由水中締合水分子的數量、締合的單個水分子個數決定。具體地說,水的密度由水分子的締合作用、水分子的熱運動兩個因素決定。當溫度升高時,水分子的熱運動加快、締合作用減弱;當溫度降低時,水分子的熱運動減慢、締合作用加強。綜合考慮兩個因素的影響,便可得知水的密度變化規律。
在水中,常溫下有大約50%的單個水分子組合為締合水分子,其中雙分子締合水分子最穩定。
多個水分子組合時,除了呈六角形外(如雪花、窗花),還可能形成立體形點陣結構(屬六方晶系)。每一個水分子都通過氫鍵,與周圍四個水分子組合在一起。邊緣的四個水分子也按照同樣的規律再與其他的水分子組合,形成一個多分子的締合水分子。由圖可知,締合水分子中,每一個氧原子周圍都有——4個氫原子,其中兩個氫原子較近一些,與氧原子之間是共價鍵,組成水分子;另外兩個氫原子屬於其他水分子,靠氫鍵與這個水分子組合在一起。可以看出,這種多個分子組合成的締合水分子中的水分於排列得比較鬆散,分子的間距比較大。由於氫鍵具有一定的方向性,因此在單個水分子組合為締合水分子后,水的結構發生了變化。一是締合水分子中的各單個分子排列有序,二是各分子間的距離變大。
在液態水變成固態水時,即水凝固成冰、雪、霜時,呈現出締合水分子的形狀。此時,水分子的排列比較“鬆散”,雪、冰的密度比較小。
0℃冰水混合物
將冰熔化成水,締合水分子中的一些氫鍵斷裂,冰的晶體消失。0℃的水與0℃的冰相比,締合水分子中的單個水分子數目減少,分子的間距變小、空隙減少,所以0℃的水比0℃的冰密度大。用倫琴射線照射0℃的水,發現只有15%的氫鍵斷裂,水中仍然存在有約85%的微小冰晶體(即大的締合水分子)。
0~4℃液態
若繼續加熱0℃的水,隨著水溫度的升高,大的締合水分子逐漸瓦解,變為三分子締合水分子、雙分子締合水分子或單個水分子。這些小的締合水分子或單個水分子,受氫鍵的影響較小,可以任意排列和運動,不必形成“鏤空”結構,而且單個水分子還可以“嵌入”大的締合水分子中間。在水溫升高的過程中,一方面,締合數小的締合水分子、單個水分子在水中的比例逐漸加大,水分子的堆集程度(或密集程度)逐漸加大,水的密度也隨之加大。另一方面在這個過程中,隨著溫度的升高,水分子的運動速度加快,使得分子的平均距離加大,密度減小。考慮水密度隨溫度變化的規律時,應當綜合考慮兩種因素的影響。在水溫由0℃升至4℃的過程中,由締合水分子氫鍵斷裂引起水密度增大的作用,比由分子熱運動速度加快引起水密度減小的作用更大,所以在這個過程中,水的密度隨溫度的增高而加大,為反常膨脹。
大於4℃液態
水溫超過4℃時,同樣應當考慮締合水分子中的氫鍵斷裂、水分子運動速度加快這兩個因素,綜合分析它們對水密度的影響。由於在水溫比較高的時候,水中締合數大的締合水分子數目比較小,氫鍵斷裂所造成水密度增加的影響較小,水密度的變化主要受分子熱運動速度加快的影響,所以在水溫由4℃繼續升高的過程中,水的密度隨溫度升高而減小,即呈現熱脹冷縮現象。

冷脹熱縮
我們知道,如果物體所受外界壓力不變,大多數物體的體積都隨溫度的升高而增大,即熱脹冷縮.與大多數物質的性質相反,在 0到4℃的溫度範圍內,水的體積卻隨溫度的升高而減小,這就是說,水在0到4℃之間是冷漲熱縮。水的這一反常性質,對江河湖泊中的動植物的生命有著重要的影響和意義.。
當寒冷的冬天來臨后,隨著氣溫的降低,江河湖泊中的水溫也隨之下降。考慮某一湖泊,設其全部湖水處於某一溫度如10℃,再設湖面上空氣的溫度為-10℃,於是湖表面的水就會變冷,比如說溫度降到9℃,這部分水因變冷而收縮,其密度比底下較暖的水為大,因而沉入下面密度較小的水中,下面的 10℃的水上升。冷水的下沉引起一個混合過程,此過程一直持續到湖泊中的所有水冷卻到4℃為止。但是表面的水還要被冷空氣繼續冷卻降溫,表面水的溫度進一步降低,又比如降到3℃,這部分水的體積不但不縮小反而膨脹,即表面水的密度比下面小,因而就浮在水面上不再下沉。對流和混合此時都停止了(當然擴散不會停止),表面下的水基本上靠熱傳導散失內能。水是熱的不良導體,這樣散熱是比較慢的。表面水的溫度,先於下面的水降至0℃、開始結冰. 冰的密度比水小,所以一直浮在水面上而不下沉。冰下面的水,從上到下溫度為0到4℃,從上到下逐漸結冰。由於通過熱傳導而向上散熱,比較慢,並且有地熱由底下向上傳導,因此凍結的速度是緩慢的。若湖泊的水很深,湖水是不會被凍透的,湖泊中生存的動植物就可以在靠近湖底的4℃的水中安然過冬,免遭凍死的厄運.。
如果水的性質也像其它大多數物質那樣,在全部溫度範圍內都是的,那麼溫度較高的水不斷升到水面,向空氣散熱,湖泊中水的凍結就會從底部開始,從而容易導致湖泊中的水全部凍結。這樣一來,就毀掉了湖泊中的一切經不起凍結的生命。