共找到2條詞條名為鈦粉的結果 展開
- 鈦粉
- 化合物
鈦粉
鈦粉
鈦粉、氫化鈦粉:純度:95-99.4%等各種規格 性 狀:鈦粉:產品呈銀灰色不規則狀粉末,有大的吸氣能力,高溫或電火花條件下易燃。
鈦粉、氫化鈦粉:純度:95-99.4%等各種規格 性 狀:鈦粉:產品呈銀灰色不規則狀粉末,有大的吸氣能力,高溫或電火花條件下易燃。氫化鈦粉:產品呈黑灰色不規則狀粉末。用途鈦粉及氫化鈦粉是一種用途非常廣泛的金屬粉末。是粉末冶金、合金材料添加劑。同時也是金屬陶瓷,表面塗復劑,鋁合金添加劑,電真空吸氣劑,噴、鍍等重要原材料。粒度-40目到-300目. 松裝密度:1.2-1.6(g/cm3)包裝:20公斤紙箱包裝,每箱4袋,經雙方協商可提供真空小包裝。
Ti Fe Si O C N Cl H Al V Ti-1 99.4 0.08 0.02 0.35 0.02 0.04 0.06 0.02 Ti-2 99.2 0.10 0.03 0.50 0.03 0.05 0.08 0.02 Ti-3 99.0 0.15 0.05 0.60 0.06 0.08 0.10 0.04 Ti-4 98.0 0.35 0.17 0.80 0.08 0.10 0.17 0.15 Ti-5 95.0 0.45 0.17 0.90 0.09 0.080 0.17 0.20 1.60 1.88
Ti Fe Si O C N Cl Al V TiH2-1 99.4 0.08 0.02 0.40 0.02 0.03 0.06 TiH2-2 98.0 0.35 0.15 0.80 0.10 0.10 0.17 TiH2-3 95.0 0.45 0.17 0.90 0.09 0.08 0.17 1.60 1.88
在金屬元素中,鈦的比強度很高。它是一種高強度但低質量的金屬,而且具有相當好的延展性(尤其是在無氧的環境下)。鈦的表面呈銀白色金屬光澤。它的熔點相當地高(超過1,649攝氏度),所以是良好的耐火金屬材料。它具有順磁性,其電導率及熱導率皆甚低。
商業等級的鈦(純度為99.2%)具有約為434兆帕斯卡的極限抗拉強度,與低等級的鋼合金相若,但比鋼合金要輕45%。鈦的密度比鋁高60%,但強度是常見的6061-T6鋁合金的兩倍。鈦可被用於各種用途。某些鈦合金(例如βC)的抗拉強度達1,400兆帕斯卡。然而,當鈦被加熱至430攝氏度以上時,強度會減弱。
儘管比不上高等級的熱處理鋼,鈦仍具有相當的硬度。鈦不具磁性,同時是不良的導熱及導電體。用機械處理時需要注意,因為如不採用鋒利的器具及適當的冷卻手法,鈦會軟化,並留有壓痕。像鋼結構體一樣,鈦結構體也有疲勞極限,因此在某些應用上可保證持久耐用。鈦合金的比勁度一般不如鋁合金及碳纖維等其他物料,所以較少應用於需要高剛度的結構上。
鈦具有兩種同素異形體,在882攝氏度時,就會從六方最密堆積的α型轉變成體心立方的β型。在到達臨界溫度前,α型的比熱會隨著升溫而暴增,但到達後會下降,然後在β型下不論溫度地保持基本恆定。跟鋯和鉿類似,鈦還存在一種ω態,在高壓時熱力學穩定,但也可能在常壓下以介穩態存在。此態一般是六邊形(理想)或三角形(扭曲),在軟性縱波聲頻光子導致β型(111)原子平面倒塌時能被觀測到。
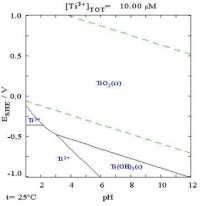
鈦的特性中,最為人稱道的就是它優良的抗腐蝕能力——它的抗蝕性幾乎跟鉑一樣好,鈦不受稀硫酸、稀鹽酸、氯氣、氯溶液及大部分有機酸的腐蝕,但仍可被濃酸溶解。雖然以下的電位-pH圖指出鈦在熱力學上是一種活性很高的金屬,但是它與水及空氣的反應是非常緩慢的。
鈦在曝露在高溫空氣中時,會生成一層鈍氧化物保護膜,阻止氧化持續。在最初形成時,保護層只有一至二納米厚,但會緩慢地持續增厚;四年間可達25納米厚。但當鈦被置於高溫空氣中時,便很容易與氧產生反應。
鈦粉
實驗指出,天然鈦在受到氘核轟擊後會具有放射性,主要釋放出正電子及硬性γ射線。 【在純水、高氯酸或氫氧化鈉中的鈦電位-pH圖見右圖】
氧化態+4在鈦化學中占首要地位,但氧化態為+3的化合物亦屬常見。正因為這樣的高氧化態,許多鈦化合物中的共價鍵高度密集。
氮化鈦(TiN)具有與藍寶石及金剛砂相當的硬度(摩氏硬度9.0),因此可作為各種切割工具的塗層,例如鑽頭。它的其他應用還包括裝飾用金色塗料及半導體器件製造中銅導線界面的擴散阻障層。
四氯化鈦(氯化鈦(IV),TiCl)是一種無色液體,也是二氧化鈦顏料製造過程的中間體。作為一種路易斯酸,四氯化鈦在有機化學反應中有廣泛應用,例如向山羥醛反應。鈦另有一種氧化數較低的氯化物,三氯化鈦(氯化鈦(III),TiCl),用作還原劑。
二氯化二茂鈦是一種重要的碳-碳鍵形成催化劑。異丙醇鈦用於夏普萊斯不對稱環氧化反應。其他化合物還包括溴化鈦(用於冶金術、超合金及高溫用電線線路及塗層)和碳化鈦(用於高溫切割工具及塗層)。
帶氮化鈦鍍膜的鑽頭
| 2003年二氧化鈦的產量 | ||
|---|---|---|
| 出產地 | 產量(千噸) | 佔總產量% |
| 澳大利亞 | 1291.0 | 30.6 |
| 南非 | 850.0 | 20.1 |
| 加拿大 | 767.0 | 18.2 |
| 挪威 | 382.9 | 9.1 |
| 烏克蘭 | 357.0 | 8.5 |
| 其他國家 | 573.1 | 13.6 |
| 全世界 | 4221.0 | 100.0 |
由於四捨五入的關係,數值總和並不等於100%。
自然中的鈦總是與其他元素結合成化合物。它是地殼中含量第九高的元素(質量佔地殼0.63%),同時也是第七高的金屬。大部分的火成岩及由其演變成的沉積岩都含有鈦(生物及天然水體也含有鈦)。實際上,在美國地質調查局分析過的801種火成岩中,784種含有鈦鈦大約佔土壤的0.5至1.5%。。
它分佈很廣,主要礦物為銳鈦礦、板鈦礦、鈦鐵礦、鈣鈦礦、金紅石、榍石及大部分鐵礦石。這些礦物中,只有金紅石和鈦鐵礦具有經濟價值,但即使是這兩種礦物,它們的高濃度礦源仍是很難找。鐵鈦礦的重要礦源主要分佈於澳洲西部、加拿大、中國、印度、莫三比克、紐西蘭、挪威及烏克蘭。北美洲及南非亦有大量開採金紅石,促使鈦金屬的年產量至九萬噸及二氧化鈦至四百三十萬噸。據估計,鈦的貯藏量超過六億噸。
鈦可以在隕石中找到,並且已在太陽及M型恆星處偵測到鈦;M型恆星是溫度最冷的恆星,表面溫度為3,200攝氏度。在阿波羅17號任務從月球帶回的岩石中,二氧化鈦含量達12.1%。鈦還可以在煤灰、植物,甚至人體中找到。
主條目:鈦的同位素
天然生的鈦有五種穩定的同位素:Ti、Ti、Ti、Ti及Ti,其中最常見的是Ti(天然丰度為73.8%)。現時已知鈦共有十一种放射性同位素,其中比較穩定的有Ti(半衰期63年)、Ti(半衰期184.8分鐘)、Ti(半衰期5.76分鐘)及Ti(半衰期1.7分鐘)。而剩下的其他放射性同位素,半衰期最長只有33秒,而大部分的半衰期更在半秒以下。
鈦各同位素的原子重量,最輕有39.99u(Ti),最重有57.966u(Ti)。最常見的穩定同位素,Ti,其主要衰變模式為電子捕獲,衰變產物為元素21(鈧)的同位素;而其次的衰變模式為β衰變,產物為元素23(釩)的同位素。
克拉普羅特以希臘神話的泰坦為鈦命名。
1791年,鈦以含鈦礦物的形式在英格蘭的康沃爾郡被發現,發現者是英格蘭業餘礦物學家格雷戈爾(Reverend William Gregor),當時正業為負責康沃爾郡的克里特(Creed)教區的牧師。他在鄰近的馬納坎教區中小溪旁找到了一些黑沙,後來他發現了那些沙會被磁鐵吸引,他意識到這種礦物(鈦鐵礦)包含著一種新的元素。經過分析,發現沙裡面有兩種金屬氧化物;氧化鐵(沙受磁鐵吸引的原因)及一種他無法辨識的白色金屬氧化物(45.25%)。意識到這種未被辨識的氧化物含有一種未被發現的金屬,格雷戈爾對康沃爾郡皇家地質學會及德國的《化學年刊》發表了這次的發現。
大約就在同時,米勒·馮·賴興斯泰因(Franz-Joseph Müller von Reichenstein)也製造出類似的物質,但卻無法辨識它。直到1795年,普魯士化學家克拉普羅特(Martin Heinrich Klaproth)獨立地從匈牙利的金紅石中再度發現到這種氧化物。克拉普羅特發現到它含有一種新的物質,並以希臘神話中的泰坦(Titans)為其命名。當他聽聞到格雷戈爾較早前的發現之後,克拉普羅特取得了一些馬納坎礦物的樣本,並證實它含鈦。
從各種含鈦礦物中提煉鈦的過程既費工又昂貴;不能像對其他金屬地用碳去還原鈦,因為鈦與碳加熱時會生成碳化鈦。歷史上最早製備出純鈦(99.9%),一直要到1910年,美國倫斯勒理工學院的亨特(Matthew A. Hunter)將四氯化鈦和鈉一起加熱至700-800攝氏度,提煉出高純度的鈦,這種方法被稱為亨特法。但是這時鈦的應用仍只限於實驗室,直到1932年克羅爾(William Justin Kroll)證明出可以利用鎂將四氯化鈦還原以提煉出鈦。八年後他改良了這個過程,當中使用鎂甚至是鈉來還原鈦,後來被稱為克羅爾法。儘管研究如何能更有效及便宜地提煉鈦的工作仍然持續(例如FFC劍橋法),但是鈦金屬的商業提煉還在使用克羅爾法。
以克羅爾法製造出來的海錦鈦
1925年,范·亞克(Anton Eduard van Arkel)及德·波耳(Jan Hendrik de Boer)發現了晶棒法(又稱碘化物精鍊法),即與碘反應后再用熱燈絲從蒸氣中分離出純金屬,利用這個方法可生產出少量的超純鈦。
在1950年代至60年代年間,蘇聯率先將鈦用于軍事及潛艇用途(661型潛艇、705型核潛艇、M級核潛艇),作為對冷戰的部分規劃。自1950年代初起,鈦開始被用於各種軍事航空用途,尤其是製造高性能噴射機,最初的機體包括F-100超級軍刀及洛克希德A-12。
在美國,國防部意識到鈦這種金屬的戰略重要性,並支持了鈦早期的商業化行動。在整個冷戰時期期間,鈦一直被美國政府視為戰略材料,國家防禦儲備中心內有大量海錦鈦庫存,直至2005年用盡為止。現時世界最大的鈦生產商,是俄羅斯的VSMPO-Avisma,據估計這家公司的全球市場佔有率達29%。
2006年美國國防部國防高等研究計劃署向兩家公司聯合撥款五百七十萬美元,研發製造鈦金屬粉末的新方法。在熱力與壓力下,這種粉末可用於製作各種強度高且重量輕的物件,從裝甲敷板到宇宙航行、運輸、化工用元件。
鈦(精礦)
處理鈦金屬主要分四個步驟:一、把鈦礦石還原成“海綿體”(一種透氣的形態);二、製造鑄錠,熔化海綿體(或用海綿體加一種母合金)來形成鑄錠;三、初步製造,把鑄錠製成一般機械製品,如坯、棒、板、片、條及管;四、加工製造,把機械製品進一步加工成型。
由於鈦在高溫時會與氧氣反應的關係,所以不能用還原反應來從氧化物中提煉鈦。因此商業上提煉鈦金屬要用到克羅爾法,一種既繁複又昂貴的分批處理法。(鈦的市價相對地高,是因為在提煉的過程中,需要氧化另一種昂貴的金屬——鎂。)在克羅爾法中,氧化物首先經過碳氯化,轉化成氯化物,過程中氯氣會在有碳的情況下,通過紅熱的金紅石或鈦鐵礦,生成四氯化鈦(TiCl)。氯化物經分餾法濃縮及提純后,在800攝氏度的氬氣中被熔鎂還原成鈦。
一種最近開發的提煉法,FFC劍橋法,日後有可能完全取代克羅爾法。此法的原料是粉末狀的二氧化鈦(一種精鍊過的金紅石),而最後成品則會是鈦粉末或海綿體。假如在原料的粉末中混入粉末狀的氧化物,那麼成品就會是廉價鈦合金,這樣做比使用一般的多步熔化法要便宜得多。FFC劍橋法使鈦不像從前那樣的如此稀少和昂貴,可為航天工業及奢侈品市場提供更多的選擇,同時可取代一些製品中的鋁或特殊等級的鋼。
一般鈦合金是由還原反應所造出來的。例如,銅鈦合金(把加了銅的金紅石還原而成)、碳鈦鐵合金(把鈦鐵礦和焦炭用電爐還原而成)和錳鈦合金(金紅石加錳或氧化錳)都是經還原而成的。
• 2FeTiO+ 7Cl+ 6C—→ 2TiCl+ 2FeCl+ 6CO
• TiCl+ 2Mg—→ 2MgCl+ Ti
現時鈦與鈦合金共有大約50種指定品位,儘管市面上能容易買到的就只有六種。美國材料試驗協會(ASTM)承認31種鈦金屬及合金品位,其中1至4號品位在商業上屬純鈦(非合金)。這四種品位以它們不同的抗拉強度區分,也就是含氧百分比,其中1號品位韌性最佳(抗拉強度低,含氧量0.18%),4號最差(抗拉強度高,含氧量0.40%)。其餘品位皆為合金,每一種配方都有其特定的用途,例如韌性、強度、硬度、電阻、抗蠕變及抗腐蝕(特定某種介質或同時多種)。
美國材料試驗協會所指定的品位及其他合金,亦會按照各種規格生產,例如宇宙航行及軍事規格(SAE-AMS, MIL-T)、ISO標準、各國的特定標準以及用家所需的規格(宇宙航行、軍事、醫學及工業用)。
至於加工方面,鈦的所有焊接必需在氬或氦其中一種惰性氣體中進行,否則鈦會被空氣中的氧、氮或氫等氣體污染。污染會引起各種情況,包括脆化,而脆化會減低焊接后的整體性,並導致連接失敗。商業純鈦的扁平產品(片、板)製造起來很容易,但處理時必須注意鈦金屬有“記憶”特性,有彈回原形的傾向。有幾種高強度合金更尤其如此。鈦金屬一般可以用跟不鏽鋼一樣的機器及方法處理。
鈦制圓柱體,品質為“2號品位”
鈦是鋼的一種合金用元素(鈦鐵),鈦會縮小鋼的晶粒尺寸,同時作為脫氧劑的鈦會減低鋼的含氧量;在不鏽鋼中加鈦會減低含碳量。鈦常與其他金屬製成合金,這些金屬有鋁(改良晶粒大小)、釩、銅(硬化)、鎂及鉬等。鈦的機械製品(片、板、管、線、鍛件、鑄件)在工業、宇宙航行、休閑及新興市場上都有應用。鈦粉在煙火製造上用於提供明亮的燃燒顆粒。
二氧化鈦是最常用的鈦化合物
從地球表面被開採的鈦礦石中,約95%都被送往提煉成二氧化鈦(TiO),一種超白的持久顏料,被用於製造塗料、紙張、牙膏及塑膠。二氧化鈦也被用於水泥、寶石、造紙用遮光劑及石墨複合魚桿、高爾夫球杆的強化劑。
粉末狀的TiO化學上具惰性,陽光下不褪色,而且很不透光:就是這些性質,使得它能夠為製造家用塑膠的灰色或棕色化學品帶來艷麗的純白色。在自然中,二氧化鈦這種化合物可在銳鈦礦、板鈦礦及金紅石這幾種礦物中找到。用二氧化鈦製成的塗料能夠耐高溫,輕度阻止塵污積聚,及抵受海洋環境帶來的影響。純二氧化鈦的折射率非常高,而且對光學色散能力比鑽石還高。除了作為一種很重要的顏料之外,防晒油也要用到二氧化鈦,因為它本身就能保護皮膚。
最近,它還被用在空氣凈化器(過濾器塗層),及貼在建築物窗上的薄膜,這種薄膜在接觸到紫外線(太陽或人工)或空氣中的水分時,會產生帶高度活性的氧化還原物種,如羥基,能凈化空氣或保持窗面清潔。
由於它的高抗拉強度-密度比、優良的抗腐蝕性、抗疲乏性、抗裂痕性及能夠在沒有蠕變的情況下抵受適度高溫,鈦合金被用於航空器、裝甲敷板、海軍艦隻、航天器與導彈。在這些應用中,鈦與鋁、釩及其他元素所製成的合金,用於製造各種元件,包括關鍵的架構部件、防火牆、起落架、排氣管(直升機)及液壓系統。事實上,約三分二的鈦金屬生產量被用於製造太空船引擎及構架。SR-71“黑鳥”是最早在架構上廣泛使用鈦的機體,為現代軍用及商用機體的鈦應用鋪好了路。據估計,生產波音777要用59噸鈦,波音747要44噸,波音737要18噸,空中客車A340要32噸,空中客車A330要18噸,空中客車A320要12噸。空中客車A380可能要用146噸,其中引擎要26噸。在引擎應用上,鈦被用於轉子、壓縮機葉片、液壓系統元件及短艙。在航空應用的鈦合金中,鈦-6鋁-4釩占幾乎50%。
由於不易被海水腐蝕,鈦被用於製造螺槳軸、索具及用於海水淡化廠的換熱器;還被用於鹹水水族館的冷熱水器、釣魚線及潛水用刀。鈦被用於製造海洋監視部署的住房及其他元件,及用於以及科學用或軍用的監察儀。前蘇聯研發出主要用鈦製造潛艇的技術。
化工及石油化工領域需要用到焊鈦制的管道及加工設備(換熱器、槽、加工用容器、閥),主要原因是鈦的抗腐蝕性。井內與鎳濕法冶金應用要用到特定的幾種合金,如鈦βC,因為需要高強度、高抗腐蝕性或兩者同時。製紙業某些會面對腐蝕性介質的生產設備會用到鈦,這些腐蝕性介質包括次氯酸鈉或濕氯氣(用於漂白)。其他應用包括:超聲波焊接、熔錫波焊及濺鍍靶材。
四氯化鈦(TiCl)是一種無色液體,在生產二氧化鈦的過程中的是一種重要的中間物,可用於生產齊格勒-納塔催化劑及製造鍍銥玻璃,還由於它在濕氣中會產生濃煙,所以可以用四氯化鈦來製造煙幕。
鈦金屬被用於汽車,尤其是賽車(汽車或摩托),在這領域減低重量,但同時不失強度及剛度是極其重要的。一般來說,鈦金屬對普羅大眾的消費市場來說太昂貴了,很難會有銷路,所以它的主要市場是高檔產品,尤其是競賽用/高性能市場。最新款的Corvette跑車可選配鈦制排氣系統。
西班牙畢爾包古根漢美術館的外牆鈦壁板
鈦被用於各種體育用品:網球拍、高爾夫球杆、袋棍球棒手柄;板球、曲棍球、袋棍球及美式足球的頭盔上的護架;以及自行車的骨架及元件。儘管鈦並不是自行車生產的主流材料,但仍有運動選手及自行車冒險愛好者使用鈦制的自行車。鈦合金亦被用於製造眼鏡框架,雖然這種鏡框會有點昂貴,但是它重量輕又很經久耐用,而且不會造成皮膚敏感。許多野外背包客都有鈦制的裝備,包括煮食用具、餐具、提燈及帳蓬的標樁。雖然比傳統的鋼或鋁製的同類稍貴,這些鈦製品要輕得多但強度不減。蹄鐵匠也偏好使用鈦,因為鈦制的馬蹄鐵比鋼製的更輕且更耐用。
適用於野外背包客的鈦叉勺約重16克,比鋼製餐具更輕,但比膠制的更堅固。
由於它的耐久性,鈦制的名牌珠寶(尤其是鈦戒指)開始普遍起來。鈦的惰性成了要選擇它的原因,特別是對有皮膚敏感或會在特定環境中(如游泳池)佩戴首飾的人。鈦的耐久性、輕重量、防凹性及耐腐蝕性,使它成為生產手錶外殼用的理想材料。有些藝術家用鈦來製作藝術品,例如雕塑、裝飾品及傢具。
鈦偶爾會被用在有關建築的應用上:位於莫斯科高40米的加加林紀念柱,為紀念第一名太空人尤里·加加林而建造,就是以鈦建成的,選用鈦的原因是因為它吸引的顏色以及跟火箭技術的關連。西班牙的畢爾包古根漢美術館及美國喜瑞都的千禧圖書館分別是歐洲和北美最早使用鈦壁板護層的建築。其他使用鈦壁板護層的建築還有位於美國科羅拉多州丹佛藝術博物館的漢密頓樓,及位於莫斯科高107米的征服太空紀念碑。
比起槍支傳統上用的金屬(鋼、不鏽鋼及鋁),鈦的強度低質量較為優勝,加上在金屬製造上的發展,用鈦來製造槍支開始變得普遍。主要用途包括手槍支架及左輪手槍的轉輪。基於同樣的理由,筆記本電腦的主體也會用到鈦(例如蘋果的PowerBook系列)。
有些高價位市場賣的工具,既輕量又耐腐蝕,例如鏟子及手電筒,也會用鈦合金製造。
小型鈦片及螺絲被用於固定眼框骨折的斷骨。
由於它的生物相容性(無毒及不被人體排斥),鈦在醫學上有廣泛應用,當中包括外科用具及植入物,例如替換髖骨框及球關節,最長可用20年。這種用途的鈦一般與4%鋁或6%鋁加4%釩製成合金。
鈦有一種固有的骨融合特性,使得鈦制的牙科植入物能在原位上逗留30年。這種特性對整形植入物而言亦相當有用。使用鈦的好處還有鈦較低的彈性模量(楊氏模量),與骨較為接近,植入物是以修補骨骼為目的而造。因此骨骼負重會更平均地分佈於骨及植入物之間,這樣會減低骨質流失的機會,因為如果負重不均就會有應力遮閉(骨骼應力因植入物而減低所導致的骨質流失),以及外科植入物與骨之間的義肢周骨折。然而,鈦合金的剛性仍是骨的兩倍,所以植入物周邊骨的受力仍是會大幅減少,並可能因此退化。
由於鈦不具鐵磁性,有鈦植入物的病人能安全地接受核磁共振成像的檢查(這對有長期植入物的人士來說是很方便的)。準備植入人體的鈦要經過等離子弧的高溫加熱,移除表面原子,新露出的表面隨即被氧化。
鈦被製成圖像導引手術用的外科器具,還有輪椅、丁形拐杖及其他需要高強度低重量的產品。
蕁麻的含鈦量最高可達百萬分之八十。
鈦沒有毒性,即使大劑量時也是如此,鈦在人體中不會發生任何自然作用。據估計,人每天會攝取約0.8毫克鈦,但大部分都在沒有被吸收的情況下通過。然而,含有硅土的組織會出現生物累積鈦的傾向。在植物中,一種未知的機制可能會用鈦來刺激碳水化合物的生產並促進生長。這可能解釋到為何大部分植物的含鈦量約為百萬分之1(ppm),而食用植物的含鈦量則約為2ppm,木賊及蕁麻更最高可達80ppm。
粉末狀的鈦及刨削下來的鈦薄片很容易引起火災,而且在空氣中會因加熱而發生爆炸。水及二氧化碳類的滅火法對燃燒中的鈦無效;必須改為使用D類乾粉滅火劑。
當生產或處理氯氣時,必須小心注意鈦只能用在周圍沒有干氯氣的地方,否則會引起鈦/氯火災。即使是濕氯氣也是火災隱患,因為在異常的天氣狀況下濕氯氣可能會意外地變干。
鈦未經氧化的新表面與液態氧接觸后可能會起火。這種表面可以由經氧化的鈦表面跟硬物碰撞后所形成,或在力學應變導致的裂痕內形成。因此在液態氧的系統內使用鈦很可能有限制,例如宇宙航行工業就會有這種系統。
應用於航天,噴塗,冶金,煙花等行業
