共價鍵理論
Heitler和London提出的理論
A、B 兩原子各有一個成單電子,當 A、B 相互接近時,兩電子以自旋相反的方式結成電子對,即兩個電子所在的原子軌道能相互重疊,則體系能量降低,形成化學鍵,亦即一對電子則形成一個共價鍵。
形成的共價鍵越多,則體系能量越低,形成的分子越穩定。因此,各原子中的未成對電子儘可能多地形成共價鍵。
飽和性:幾個未成對電子(包括原有的和激發而生成的),最多形成幾個共價鍵。例如:O有兩個單電子,H有一個單電子,所以結合成水分子,只能形成2個共價鍵;C最多能與H 形成4個共價鍵。
方向性:各原子軌道在空間分佈是固定的,為了滿足軌道的最大重疊,原子間成共價鍵時,當然要具有方向性。
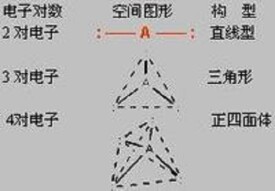
ABn 型分子的幾何構型取決於中心 A 的價層中電子對的排斥作用. 分子的構型總是採取電子對排斥力平衡的形式.
1)中心價層電子對總數和對數
a)中心原子價層電子 總數等於中心 A 的價電子數加上配體在成鍵過程中提供的電子數,如
做配體時:提供電子數為 0,如在 中.
c)處理離子體系時,要加減離子價
d)總數除以 2 ,得電子對數:總數為奇數時,對數進 1,例如:總數為 9,對數為 5
2)電子對和電子對空間構型的關係
電子對相互排斥,在空間達到平衡取向. 3)分子的幾何構型與電子對構型的關係
若配體數和電子對數相一致,各電子對均為成鍵電對,則分子構型和電子對構型一致。配體數不可能大於電子對數. 當配體數少於電子對數時,一部分電子對成為成鍵電對,另一部分電子成為孤對電子,確定出孤對電子的位置,分子構型才能確定。考慮分子構型時,只考慮原子 A,B 的位置,不考慮電子、對電子等。以上三種情況中,孤對電子只有一種位置考慮。
孤對電子的位置若有兩種或兩種以上的位置可供考慮,則要選擇斥力易於平衡位置,而斥力大小和兩種因素有關:
a)角度小,電對距離近,斥力大;
b)角度相同時,孤對——孤對的斥力最大。因為負電集中,孤對-成鍵斥力次之,而成鍵電對-成鍵電對之間斥力最小,因有配體原子核去分散電對的負電性。於是,要避免的是斥力大的情況在 90°的方向上。多重鍵的處理
某配體(非ⅥA族)與中心之間有雙鍵和三鍵時,價層電子對數減 1 或 2。
如乙烯 以左碳為中心
電子總數 , 4對,減 1,3 對,為三配體,呈平面三角形。不提供共用電子,是因為O,S 等可通過鍵,反饋鍵或大鍵,將提供的電子又重新得回; 另外,端基氧或硫,形成的雙鍵,要求減去一對價電子,也得到同樣結果.
非端基氧或硫,要將O或S的價電子計入其中,如在中,C為中心,價電子為,價電對= 3,電子對構型和分子構型一致,為三面體。