價層電子對互斥模型
希吉維克和坡維爾提出的模型
價層電子對互斥模型是將共用電子對與孤對電子的概念,與原子軌道的概念相結合,且電子斥力達到最小。在這個模型中電子對相互排斥,成鍵電子與孤對電子距離越遠越好。VSEPR模型以最簡單的方法形象化了化學變化,也很容易判斷物質的空間構型。
在1940年,希吉維克(Sidgwick)和坡維爾(Powell)在總結實驗事實的基礎上提出了一種簡單的理論模型,用以預測簡單分子或離子的立體結構。這種理論模型后經吉列斯比(R.J,Gillespie)和尼霍爾姆(Nyholm)在20世紀50年代加以發展,定名為價層電子對互斥模型,簡稱VSEPR(Valence Shell Electron Pair Repulsion)。
價層電子對互斥理論(英文VSEPR),是一個用來預測單個共價分子形態的化學模型。理論通過計算中心原子的價層電子數和配位數來預測分子的幾何構型,並構建一個合理的路易斯結構式來表示分子中所有鍵和孤對電子的位置。同時,也是一種較簡便的判斷共價分子幾何形狀的方法,該理論緊緊抓住中心原子價層電子對數目這一關鍵因素,運用分子的幾何構型取決於價層電子對數目這一假設,成功的解釋並推測了許多簡單分子的幾何形狀.
價層電子對互斥理論常用AXE方法計算分子構型。這種方法也叫ABE,其中A代表中心原子,X或B代表配位原子,E代表孤電子對。
一個分子的形狀不但受配位原子影響,也受孤對電子影響。氨分子(NH)中心原子雜化類型與甲烷相同(sp ),分子中有四個電子云密集區,電子云分佈依然呈四面體。其中三個是成鍵電子對,另外一個是孤對電子。雖然它沒有成鍵,但是它的排斥力影響著整個分子的形狀。因此,這是一個AXE型分子,整個分子的形狀是三角錐形,因為孤對電子是不可“見”的。
事實上,電子對數為七是有可能的,軌道形狀是五角雙錐。但是它們僅存在於不常見的化合物之中。一種如六氟化氙,有一對孤電子,它的構型趨向於八面體結構,因為孤對電子傾向於位於五角形的平面上。另一種如七氟化碘,沒有孤電子,七個氟原子呈五角雙錐狀排列。
電子對數為八也是有可能的。理論要點
①對於ABm型共價分子:中心原子周圍電子對排布的幾何形狀,主要取決於中心原子的價電子對數,而價電子數等於成鍵電子對和未成鍵的孤電子對之和.
②價電子對要盡量遠離,減小排斥

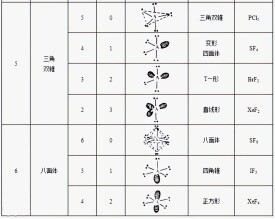
常見分子的構型
三對────平面三角形最遠
四對────四面體(正四面體)
五對────三角雙錐
六對────正八面體
一般說來,孤電子對、成鍵電子對之間斥力大小的順序為:孤電子對~孤電子對>孤電子對~成鍵電子對>成鍵電子對~成鍵電子對
③價層電子對排布方式與分子構型有關
只有σ鍵才能撐起分子骨架,所以分子構型與價對構型有時一致有時不一致,根據鍵對與孤對數目判斷構型。
規則:
m為中心原子周圍B原子個數.
特別注意:當算出的n值不是整數值時,有2種取值方法.
①時,只取整數位.(例如只取)
②時,採取四捨五入.(例如,取值為)
例如:HO 價對四面體→sp 雜化
2個鍵對,2個孤對 分子為V構型
NH 四面體分子→sp 雜化
3個鍵對,1個孤對 分子為三角錐型BF 平面三角形→sp 雜化
3個鍵對,0個孤對 分子為平面三角形
O 價電對→sp 雜化
2個鍵對,1個孤對 分子為V構型
注意:外來電子處在中心原子上,即得也得在中心原子上,失也失在中心原子上
例如:(I) 價電對→sp d雜化
價對構型為三角雙錐,2個鍵對,3個孤對,分子為直線型。
規則中,m為成鍵電子對數,n為孤電子對數
值除可以判斷分子幾何形狀外,還可以用來判斷AB型分子的極性。
注意:若 則該分子也為非極性分子.因為在時,兩對孤電子對替代八面體上下兩對成鍵電子對,其餘的四對成鍵電子對與兩對孤電子對所形成的平面四邊形為對稱結構,所以時分子也為非極性分子
對於一個中心原子和配位原子,我們首先計算價層電子的對數P,即有多少對電子。(孤對電子數目+成鍵電子數(包括配位原子的成鍵電子)目除以2),為了儘可能的分開。為直線,為平面,為四面體,為三角雙錐,為八面體,為五角雙錐。
1.不同鍵電子對之間排斥作用的大小順序為:三鍵排斥>雙鍵排斥>單鍵排斥。
2.孤對電子與鍵對電子間的排斥大小為:孤對/孤對>孤對/鍵對>鍵對/鍵對。
3.配位原子的電負性增大或中心原子電負性減小,也會使鍵角偏離標準值。端原子電負性增加時,共享電子對將偏向配位體,從而減少成鍵電子對之間的斥力,鍵角的度數隨之減小。
VSEPR能夠廣泛預測定性預測各類ABn型分子的幾何構型,但也有例外。例如BaI2,SrCl2都是彎曲形構型而非預計的直線性型;對過渡金屬化合物幾何構型的判斷也有一定的局限性,對於過度元素配位場理論則能更好說明。