穿孔素
穿孔素
穿孔素(英文:Perforin)是人體內一類由PRF1基因編碼的“蛋白質”。
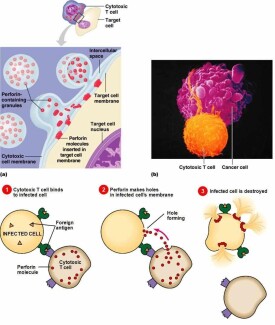
穿孔素(perforin,屬於成孔蛋白pore-forming protein, PFP)是一種分子量為67kD,存在於細胞毒性T淋巴細胞(CTL)和NK細胞胞質的細胞毒顆粒中的糖蛋白,又稱C9相關蛋白或溶細胞素(cytolysin),成熟的穿孔素分子由534個氨基酸殘基組成,分子量為56-75kDa,IP為6.4,穿孔素分子中央部位170-390之間的氨基酸序列與C9328-560氨酸酸序列約有20%同源性。當與靶細胞密切接觸相互作用后,細胞可釋放穿孔素。穿孔素的作用是在靶細胞膜上形成多聚穿孔素管狀通道,導致靶細胞溶解破壞。在Ca2+存在下,插入靶細胞膜上,並多聚化形成管狀的多聚穿孔素(polyperforin),約含12-16個穿孔素分子,分子量可達1000kDa。多聚穿孔素在靶細胞膜上形成穿膜的管狀結構,內徑平均16nm。這種異常的通道使Na+、水分進入靶細胞內,K+及大分子物質(如蛋白質)從靶細胞內流出,改變細胞滲透壓,最終導致細胞溶解。此過程與補體介導的溶細胞過程類似,溶解細胞過程比較迅速。CTL本身可能釋放A型硫酸軟骨素蛋白聚糖(proteoglycans of chondroitinsulphate A type)、硫酸軟骨素A限制因子(homologous restriction factor,HRF),因此可避免穿孔素對CTL自身細胞的攻擊。
1、穿孔素儲存於CTL細胞和NK細胞的胞漿顆粒中,是這些細胞殺傷靶細胞的主要效應分子。
2、CTL和NK細胞被激活后胞漿顆粒釋放出來,穿孔素單體可迅速插入靶細胞的胞漿膜,多個單體聚合形成打孔聚合物,在靶細胞膜上形成不同孔徑的跨膜通道,從而導致靶細胞膜去極化,使細胞外水分進入細胞內,一些電解質和大分子物質流出細胞外,最終引起靶細胞滲透性死亡。
3、對靶細胞進行攻擊后的CTL和NK細胞與裂解細胞分離,又可攻擊其他靶細胞。
4、穿孔素形成的孔還可以使顆粒酶進入靶細胞,引起靶細胞凋亡。
5、穿孔素還可使一些顆粒分子如顆粒溶解素(granulysin)進入靶細胞內,對胞內感染髮揮免疫作用。
在乙型病毒性肝炎中的作用
乙肝病毒無直接致細胞病變作用,肝細胞的損傷是乙肝病毒與機體的免疫系統相互作用的結果。在急性乙肝病毒感染期間,機體通常形成強烈的多克隆、多特異性的T細胞應答,反應可以針對乙肝病毒蛋白的多個表位,因此,病毒通常被清除,感染呈自限性的過程。在慢性乙肝病毒感染期間,特異性CD4+和CD8+T細胞的功能均低下,因此病毒難以被清除。CTLs的細胞毒效應是清除肝細胞內乙肝病毒的主要機制。通常,CTLs依賴兩條獨立的途徑發揮其細胞毒作用,即穿孔素途徑和凋亡途徑。
在鼠肝炎模型中穿孔素的研究
在乙肝病毒轉基因鼠的研究中,發現Fas配體(FasL)和穿孔素可以誘導肝臟的損害,但是體內的CTLs必須要同時激活這兩條信號途徑才能引起對靶細胞的殺傷。給HBV轉基因小鼠過繼MHC-Ⅰ類抗原限制的HBsAg特異性CTLs,可以誘發典型的急性肝炎。
其免疫病理過程為:首先,HBsAg特異性CTLs進入肝內黏附於HBsAg陽性細胞,通過FasL/Fas和穿孔素途徑導致大部分肝細胞的凋亡和壞死;其次,中性粒細胞等炎性細胞聚集並殺傷肝細胞;再次,在TNF-α和IFN-γ等細胞因子的參與下,大量淋巴細胞、單核細胞浸潤和Kupffer細胞活化,使HBsAg陽性肝細胞大量死亡。比較研究顯示,急性土撥鼠肝炎的PBMCs更具細胞毒性,這種毒性的增加完全是由穿孔素介導的。
在乙肝患者中穿孔素的研究
較早的研究發現,在慢性乙肝患者肝組織中,肝內T淋巴細胞和Kupffer細胞表達穿孔素和顆粒酶B,而正常人肝組織中缺乏這兩種蛋白的表達。Tagashira等在15例慢性乙肝患者肝組織活檢標本中均檢測到穿孔素mRNA,而在脂肪肝、Gilbert綜合征和Dubin-Johnson綜合征等患者的肝組織中則不能檢測到。
半定量分析顯示,慢性乙肝患者肝組織穿孔素mRNA的強度與組織活動性指數及血清ALT水平呈正相關關係。
在丙型病毒性肝炎中的作用
急性丙型肝炎通常沒有臨床癥狀,但容易變成慢性肝炎。慢性丙型肝炎的組織學特徵是單個核細胞的浸潤和肝細胞的壞死和纖維化,但HCV感染的發病機制仍不十分明了。一方面,HCV可能對肝細胞有細胞病變效應,肝細胞的脂肪變可能是HCV直接導致的,特別是HCV基因3型;另一方面,HCV又被認為是非致細胞病變病毒,HCV感染的患者CTLs在病毒的清除和肝細胞的損傷中發揮了重要的作用。
在丙肝急性期,研究發現HCV特異性CD8+T細胞增生低下,表達穿孔素水平較低,溶細胞活性下降和產生干擾素-γ減少。但在急性自限性的丙肝患者中,這種缺陷是短暫的,HCV特異性CD8+T細胞的功能會因病情的改善而得到恢復。
穿孔素蛋白扮演清道夫角色
2010年10月31日,據美國物理學家組織網報道,澳大利亞和英國的一個聯合研究小組發現,一種被稱為穿孔素的蛋白質可在細胞膜上打孔,從而殺死體內的無賴細胞。他們發現的這種“刺殺”機制有助於研發提高免疫力或是根據需要抑制免疫力的新方法。
該研究項目負責人、澳大利亞莫納什大學的詹姆斯・威什托克稱,穿孔素是人體中的死亡武器和清道夫。它們能強行闖進被病毒劫持了的細胞或癌細胞中,從而使有毒的酶進來,從內部破壞細胞。沒有它們,我們的免疫系統就無法殺死受感染細胞和癌變細胞。
實驗過程
澳大利亞莫納什大學、墨爾本彼得・麥卡勒姆癌症中心和英國倫敦大學伯克貝克學院的研究人員進行了為期10年的合作,共同分析穿孔素的蛋白質職能,也就是它的結構和功能。
他們利用在澳大利亞的同步加速器,揭示了蛋白質的結構。然後通過伯克貝克學院強大的電子顯微鏡,根據單個穿孔素分子的精細結構,構建了穿孔素蛋白在樣本膜上形成孔洞的系列模型,揭示了這種蛋白質是如何裝配組合併在細胞膜上打出孔洞的。
新研究也證實穿孔素蛋白分子跟一些細菌分泌的毒素非常相似,比如炭疽病菌、李斯特菌和鏈球菌。但是,當正常細胞被誤認為是應該清除的細胞時,穿孔素也會犯錯誤,這種情況就會導致自體免疫疾病,比如組織對骨髓移植的排斥。
應用機制