八面體間隙
結構化學學科中的術語
在八面體型間隙相中,6個金屬原子構成八面體,間隙原子位於八面體中心的間隙位置,具有這種間隙類型的間隙相可以是面心立方、密排六方、正交和體心立方等點陣的碳化物、氮化物以及複雜面心立方結構的M6C型碳化物等。
晶體是由原子、離子、分子或離子基團在空間按一定規律重複排列構成的固體物質。從晶體中無數個重複的等同基本單位抽象出來的無數個點,而且連接其中任意兩點的向i平移后能使這組點復原,則這組點稱為點陣。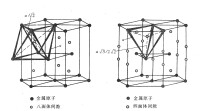

八面體間隙
為了便於理解,將晶胞中的原子或離子看成是具有一定半徑的球體,將原子或離子問的相互結合看成是球體的相互堆積。當原子或離子相互結合成新化合物時,要求彼此問的引力和斥力達到平衡,以使晶體具有最小的內能。如圖所示,這在球體堆積中,就要求球體相互間呈最緊密堆積狀態,這些通稱為球體緊密堆積原理。
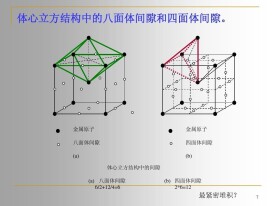
由上圖可以看出,在相等大小的球體緊密堆積中,球體間仍然有間隙存在,這種間隙有兩種方式存在,一種是四面體間隙,另一種是八面體間隙。六方緊密堆積和面心立方緊密堆積是兩種最簡單的堆積方式,其中每個球所接觸到的同種球個數為12,空間利用率即緻密度為74.05%,空隙占整個晶胞體積的25.95%。但是,體心立方排列不屬於緊密堆積,其空間利用率僅為68.02%。
馬氏體的形成是由於基體金屬鐵通過切變發生點陣重構。合金元素碳不能擴散而全部保留在切變后的晶格內部,所以馬氏體是碳在α-Fe中的過飽和固溶體,過飽和程度隨鋼中碳的質量分數增加而增加。碳位於體心立方晶格的扁八面體間隙中心,如圖所示:
根據計算,扁八面體間隙短軸方向上間隙半徑僅為0.019nm,而碳原子半徑為0.077nm,因此,Fe的碳溶解度是極小的。碳“擠入”扁八面體間隙中心時,使扁八面體短軸伸長,長軸相應收縮,引起點陣畸變,畸變嚴重時體心立方點陣變成了體心正方點陣。正方度c/a隨溶碳量的提高而增加.如下圖示,點陣常數與馬氏體中碳的質量分數呈線性關係。因此,可以通過測定正方度來確定馬氏體中碳的質量分數。
奧氏體學名叫γ-Fe,為面心立方結構,存在八面體間隙和四面體間隙。八面體間隙比四面體間隙大,間隙原子處於八面體間隙中心,即處於面心立方晶胞的體心和棱邊的中心,如下圖所示:
晶胞中的八面體間隙數為4,理論上一個晶胞可以溶人4個間隙原子,即碳在γ-Fe中的最大溶解度為50%(摩爾分數),質量分數約20%。實際上,即使在1147℃,碳在奧氏體中的最大溶解度也只有2.11%。因為八面體間隙半徑僅為0.52nm,而碳的原子半徑為0.077nm。所以.碳是強行“擠入”到γ-Fe的晶格間隙中,造成點陣畸變,使鄰近間隙繼續溶碳困難。事實上,只有約2.5個晶胞才能溶人一個碳原子。碳在八面體間隙位置也是隨機的,呈統計性均勻分佈,且存在濃度起伏。間隙原子的存在,使奧氏體晶胞膨脹,點陣常數發生變化。隨溶碳量的增加,點陣常數變大.如下圖所示,
可以通過測量奧氏體點陣常數的變化來確定奧氏體中的碳含量。置換原子也會引起奧氏體晶格畸變和點陣常數變化,但變化相對較小。奧氏體組織形態與奧氏體化前的原始組織、加熱溫度及加熱轉變程度等有關,通常是由等軸狀多邊形晶粒組成,晶界較為平直。有的奧氏體晶內可能存在相變孿晶面。
面心立方NaCl型結構,正、負離子比r/r為0.732~0.414,點陣結構如圖所示:
從離子堆積來看,半徑較大的氯離子呈面心立方緊密堆積,鈉離子填充其所有的4個八面體空隙,配位數均為6,靜電鍵強度為1/6。從配位多面體來看,整個NaCl晶體是配位八面[NaCl]以共用棱的方式整齊地堆積起來的。
四方晶金紅石TiO2型結構屬於AB型化合物,正、負離子半徑比為0.732~0.414,屬於四方晶結構。Ti離子佔據晶胞頂點和體心位置,6個O離子構成八面體將Ti離子包圍起來,因此,Ti離子和O離子的配位數分別為6和3,其點陣結構如圖所示: