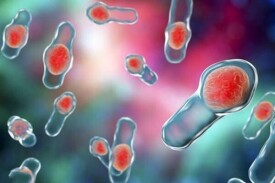
內毒素
革蘭氏陰性菌體中存在的毒性物質的總稱
革蘭氏陰性菌,(如傷寒桿菌,結核桿菌,痢疾桿菌等)的菌體中存在的毒性物質的總稱。是多種革蘭氏陰性菌的細胞壁成分,由菌體裂解后釋出的毒素,又稱之為“熱原”。單位Eu/ml。其化學成分有磷脂多糖-蛋白質複合物,其毒性成分主要為類脂質A。內毒素位於細胞壁的最外層、覆蓋於細胞壁的黏肽上。各種細菌的內毒素的毒性作用較弱,大致相同,可引起發熱、微循環障礙、內毒素休克及播散性血管內凝血等。內毒素耐熱而穩定,抗原性弱。可刺激機體產生抗體,但無中和作用,形成抗毒素,經甲醛處理不能成為類毒素。
內毒素是革蘭氏陰性細菌細胞壁中的一種成分,叫做脂多糖。脂多糖對宿主是有毒性的。內毒素只有當細菌死亡溶解或用人工方法破壞菌細胞后才釋放出來,所以叫做內毒素。
內毒素不是蛋白質,因此非常耐熱。在100℃的高溫下加熱1小時也不會被破壞,只有在160℃的溫度下加熱2到4個小時,或用強鹼、強酸或強氧化劑加溫煮沸30分鐘才能破壞它的生物活性。與外毒素不同之處在於:內毒素不能被稀甲醛溶液脫去毒性成為類毒素;把內毒素注射到機體內雖可產生一定量的特異免疫產物(稱為抗體),但這種抗體抵消內毒素毒性的作用微弱。
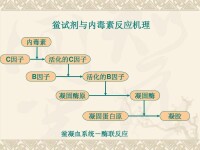
內毒素反應機理
人體對細菌內毒素極為敏感。極微量(1-5納克/公斤體重)內毒素就能引起體溫上升,發熱反應持續約4小時后逐漸消退。自然感染時,因革蘭氏陰性菌不斷生長繁殖,同時伴有陸續死亡、釋出內毒素,故發熱反應將持續至體內病原菌完全消滅為止。內毒素引起發熱反應的原因是內毒素作用於體內的巨噬細胞、中性粒細胞等,使之產生白細胞介素1、6和腫瘤壞死因子α等細胞因子,這些細胞因子作用於宿主下丘腦的體溫調節中樞,促使體溫升高發熱。
細菌內毒素進入宿主體內以後,血流中占白細胞總數60-70%的中性粒細胞數量迅速減少,這是因為細胞發生移動並粘附到組織毛細血管上了。不過1-2小時后,由內毒素誘生的中性細胞釋放因子刺激骨髓釋放其中的中性粒細胞進入血流,使其數量顯著增加,有部分不成熟的中性粒細胞也被釋放出來。革蘭氏陰性菌的傷寒沙門菌是例外,其內毒素使白細胞總數始終是減少狀態。由於絕大多數被革蘭氏陰性菌感染的患者血流中白細胞總數都會增加,所以醫生在診斷前,為了初步區別是細菌性感染還是病毒性感染,常常要化驗病人的血液,對白細胞進行總數測定和分類計數。被病毒感染的病人,其白細胞總數和中性粒細胞百分比基本在正常值範圍內。
內毒素
關於內毒素休克,過去曾有過慘痛的教訓。20世紀40年代青霉素剛問世的時候,醫生髮現青霉素對腦膜炎奈瑟菌引起的流行性腦膜炎療效非常顯著。因此,凡發現這類病人,一律優選青霉素進行治療;且按照一般規律,用藥劑量隨病情嚴重程度而遞增。結果發生了意外,用大劑量青霉素治療重症腦膜炎患者時,不少發生了內毒素休克而死亡。後來經過研究分析,發現了其中的原委。病情嚴重的患者,體內存在的病原菌數量多,醫生採用大劑量“轟炸”,意欲“一舉殲敵”。快速、徹底殺滅病原體,這種戰略無可非議,但有些醫生忽略了另一方面,即流行性腦膜炎的病原菌是屬革蘭氏陰性菌的腦膜炎奈瑟菌,其致病物質是內毒素,而內毒素是要在病菌死亡后再放出的。如今用大劑量青霉素一下子將全部病菌殺死,也就是使大量內毒素一次放出,促成了內毒素休克,加速了患者的死亡。隨著醫學的進步,醫生遇到這類病人,一方面仍然要用大劑量的有效抗菌藥物去對付,同時要加用激素類藥物,以保護對內毒素敏感的細胞不對內毒素誘生的細胞因子發生反應,從而度過“休克”難關。猶如外科手術時,採用麻醉藥使病人喪失痛覺一樣。
病原微生物又可稱為病原菌,是指能入侵宿主引起感染的微生物,有細菌、真菌、病毒等。
人體內毒素
霍亂弧菌、痢疾桿菌和大腸桿菌能產生分泌到它們細胞外面的腸毒素引起患者腹瀉;鼠疫桿菌分泌的鼠疫毒素作用於全身血管及淋巴使其出血和壞死;還有些細菌產生不分泌到菌體細胞外的毒素,例如沙門氏菌。當我們不小心弄破了手足而傷口比較深時,或者被銹鐵釘扎到肉中,必須到醫院去注射預防針,預防由梭狀芽孢桿菌引起的破傷風。梭狀芽孢桿菌也來自土壤,是一種不喜歡氧氣的厭氧菌。它在氧氣較少的深部傷口中繁殖,併產生一種能致人於死地的毒素。還有一種梭狀芽孢桿菌,它們會產生一種已知對人類最厲害的毒素(0.1微克就足以致人死命),它並不在宿主體內繁殖,而是在罐頭裡腌制的魚和肉類中繁殖併產生毒素。不過現代先進有效的食品保藏方法使肉毒中毒症變得很少見了。
病原菌的致病物質可分為毒素和侵襲力兩大類。毒素對宿主有毒,能直接破壞機體的結構和功能。侵襲力本身無毒性,但能突破宿主機體的生理防禦屏障,並可在機體內生存下來(醫學上稱為定殖)、繁殖和擴散。如果把毒素當作“元兇”,那侵襲力就是“幫凶”。
根據性質、作用和產生菌的不同,病原菌的毒素分為外毒素和內毒素兩種。下面的表格列出了細菌外毒素和內毒素的主要區別。
內毒素
| 區別要點 | 外毒素 | 內毒素 |
| 產生菌 | 多數革蘭氏陽性菌,少數革蘭氏陰性菌 | 多數革蘭氏陰性菌,少數為革蘭氏陽性(如蘇雲金芽孢桿菌) |
| 存在部位 | 多數活菌分泌出,少數菌裂解后釋出。 | 細胞壁組分,菌裂解后釋出 |
| 化學成份 | 蛋白質 | 脂多糖 |
| 毒性作用 | 強,對組織細胞有選擇性毒害效應,引起特殊臨床表現 | 較弱,各種類的毒性效應相似,引起發熱、白細胞增多、微循環障礙、休克等 |
| 免疫抗原性 | 強,刺激宿主產生抗毒素。 | 較弱,甲醛液處理后不形成類毒素。 |
| 穩定性 | 60℃半小時被破壞。 | 160℃2-4小時被破壞 |
| 處理方式 | 特定抗生素治療為主。 | 消炎藥物、抗氧化劑治療為主。 |
由於內毒素是細菌死亡裂解或自溶引起的,因此環境中大量存在內毒素。當內毒素通過機體消化道等方式時並無危害,少量通過注射等方式進入血液后被肝臟枯否細胞滅活,不造成機體損害。內毒素大量進入血液就會引起發熱反應—“熱原反應”。內毒素大量進入、集聚於血液中,超過機體各自衛系統的清除能力,則可導致不同程度的內毒素血症。對於易於引入內毒素的藥品醫療器械等必須通過內毒素檢測。內毒素的檢測常用家兔熱原法和鱟試驗法。中國藥典收錄的細菌內毒素檢查法包括2種方法:凝膠法和光度法,使用鱟試劑來定性或定量檢測內毒素。
內毒素血症是由於血中細菌或病灶內細菌釋放出大量內毒素至血液,或輸入大量內毒素污染的液體而引起的一種病理生理表現。內毒素血症分為內源性和外源性兩大類。
(1)內毒素血症發生的原因
在嚴重創傷、感染等應激狀態下可出現:全身網狀內皮系統功能障礙,免疫機能下降,腸道吸收的內毒素過多而超過機體清除能力;胃腸道粘膜缺血、壞死、屏障破壞,大量內毒素釋放入血;腸道吸收的內毒素因肝功能障礙由側枝循環直接入體循環;某些組織、器官的感染引起外源性內毒素入血。
(2)內毒素血症的臨床癥狀
內毒素血症臨床癥狀主要決定於宿主對內毒素的抵抗力。癥狀和體征有:發熱,白細胞數變化,出血傾向,心力衰竭、腎功能減退、肝臟損傷、神經系統癥狀,以及休克等。內毒素可引起組胺、5-羥色胺、前列腺素、激肽等的釋放,導致微循環擴張,靜脈迴流血量減少,血壓下降,組織灌流不足,缺氧及酸中毒等。
(3)內毒素血症的後果
內毒素血症可以出現在多系統的多種疾病中,通常導致致死性感染性休克、多器官功能衰竭、瀰漫性血管內凝血等,病死率極高。
內毒素血症可引起一系列病理生理改變:
①發熱反應:內毒素直接作用於下丘腦體溫調節中樞,或作用於白細胞使之釋放內原性致熱原
②促使血管活性物質如緩激肽、組胺、5-羥色胺等釋放,使血壓下降,導致微循環障礙即中小血管動脈粥樣硬化
③引起白細胞和血小板減少,激活凝血、纖溶系統,產生出血傾向;瀰漫性血管內凝血,如腦血栓等
④經C3旁路或經典途徑激活補體
⑤直接或間接損害肝臟,如脂肪肝等;引起糖代謝紊亂及酶學、蛋白代謝的改變,如糖尿病等
⑥激活白三烯、前列腺素、巨噬細胞、單核細胞及內皮細胞活性即產生亞急性和慢性的炎症反應。
(4)各類疾病內毒素血症的發生率
急性肝炎37-64%;爆發性肝炎58-100%;丙肝61.54%;膽石症伴急性梗阻性化膿性感染85%;燒傷85%;敗血症70%;多器官功能衰竭100%;急性胰腺炎90%;皮膚軟組織感染70-81.1%;腹腔感染72-84%;尿路感染70-80%(腎炎)、癌症70%;肺炎100%;上感100%。
(5)內毒素血症的治療
內毒素血症的治療原則多主張:
①減少內毒素的產生和吸收
②改善內毒素引起的微循環障礙。
許多非革蘭氏陰性菌感染的重症病人及處於應激狀態的患者,絕大部分出現內毒素血症,血漿中內毒素血症主要來源於腸道內毒素的吸收,因此腸源性內毒素血症是病人死亡的主要原因。
腸源性內毒素血症的發病機制與如下幾方面有關:
(1)腸道內毒素生成和攝取增多(腸道微生物移位)機體免疫功能受損和腸粘膜免疫屏障的破壞,內毒素移位,進入血循環;腸粘膜屏障功能障礙,粘膜缺血、萎縮、破損、脫落均可造成內毒素移位,發生腸源性內毒素血症;腸道微生態環境破壞,廣譜抗生素的長期應用減少了對抗生素敏感的厭氧菌的數量,導致革蘭氏陰性菌大量繁殖,突破粘膜屏障而移位進入血循環。
(2)肝臟對內毒素的清除功能減退,大量內毒素在肝臟未經解毒溢入體循環。
(3)門體系統功能障礙,出現門體分流,來自腸道的內毒素繞過肝臟,未經滅活解毒,湧入體循環,形成內毒素血症。
(4)淋巴液生成增加,腹腔淋巴管--胸導管是內毒素進入體循環的重要替代途徑。
(5)外周血內毒素滅活功能降低,各種原因造成的外周血滅活內毒素能力下降,易發生腸源性內毒素血症。
1. 最精確的溫度控制:環境溫度15-30℃,濕度40-60%時,檢測儀溫度控制在37℃± 0.5℃。
2. 最堅固的機體:整體設計,不用移動組件,組件不易損壞,機體長時間穩定運行,儀器不需要經常校準,維護費用低。
3. 最靈敏的鱟試劑:使用濁度法鱟試劑檢測靈敏度可達到0.001EU/ml,檢測結果可保留2-4位有效數字。
4. 最低的鱟試劑使用量:鱟試劑的使用量僅為0.05ml,可成倍的節約成本。
5. 最真實的溫度顯示:實時檢測溫度,80%的時間內溫度可穩定在整37℃。
6. 最方便的檢測程序:每天只需做一次陰性檢測和陽性檢測,每個批號的鱟試劑只需做一條標準曲線,有效的節約成本簡化操作。
7. 最強大的檢測能力:96個檢測孔,每個孔都是獨立的,用戶可同時建立96個檢測方案。
8. 最權威的檢測系統:該系統是世界上公認的權威系統,它在內毒素檢測領域處於領先地位,結果報告可用於FDA的申報。
軟體的功能特點:
1. 操作界面簡單快捷,功能豐富,用戶只需要第一次使用時進行簡單設置。
2. 可保存設置、檢測方案、檢測結果以及標準曲線,並能隨時提取保存文件,保存的文件可自動或手動命名。
3. 可批量設置檢測方案,標準曲線一次設置自動標出所有點。
4. 可隨時(包括檢測進行中)添加、刪除、更改檢測方案。
5. 檢測結束后自動進行數據分析,也可打開以前的數據進行分析。
6. 自動繪製出標準曲線,包括相關係數、斜率、截距,可將不合格的點去除,並可隨時調用曲線。
7. 自動計算內毒素含量、樣品回收率、相關係數、變異係數,並能自動判斷檢測過程及結果是否合格。
8. 為了防止由於斷電等原因導致的系統中斷,系統自動保存中斷前的數據及設置。
9. 系統數據及檢測結果,可列印出報告,報告符合美國FDA要求。
| 規格 | 96孔 |
| 電源規格 | 100-250V 50/60HZ |
| 光源 | 870nm LED |
| 控制溫度 | 37± 0.5°C |
| 介面 | RS-232C |
| 儀器尺寸 | 40.6(長)x45.7(寬)x9.5(高)[cm] |
| 重量 | 12.5kg |
| 數據傳輸格式 | ASCII character strings,9600 baud |