半不連續複製
生物學術語
DNA複製是一種在所有的生物體內都會發生的生物學過程,是生物遺傳的基礎。對於雙鏈DNA,即絕大部分生物體內的DNA來說,在正常情況下,這個過程開始於一個親代DNA分子,最後產生出兩個相同的子代DNA分子。親代雙鏈DNA分子的每一條單鏈都被作為模板,用以合成新的互補單鏈,這一過程被稱為半保留複製。細胞的校正機制確保了DNA複製近乎完美的準確性。
DNA複製的最主要特點是半保留複製,另外,它還是半不連續複製(Semidiscontinuous replication)。半不連續模型是DNA複製的基本過程。
問題的提出
1968年岡崎提出DNA不連續複製模型(P418圖34-18),認為新合成的3‘→5‘走向的DNA鏈實際上是有許多5‘→3‘方向合成的DNA片斷連接起來的。
DNA半不連續複製
DNA複製時,以3‘→5‘走向為模板的一條鏈合成方向為5‘→3‘,與複製叉方向一致,稱為前導鏈;另一條以5‘→3‘走向為模板鏈的合成鏈走向與複製叉移動的方向相反,稱為滯后鏈,其合成是不連續的,先形成許多不連續的片斷(岡崎片斷),最後連成一條完整的DNA鏈。
DNA聚合酶不能發動新鏈的合成,只能催化已有鏈的延長;RNA聚合酶則不同,只要有模板存在,不需引物,就可以合成新RNA鏈。因此在體內先由RNA聚合酶合成RNA引物,DNA聚合酶再從RNA引物的3‘-OH端開始合成新的DNA鏈。催化RNA引物合成的酶稱為引物合成酶。
DNA複製的複雜性保證了複製的高度忠實性
半不連續複製
在複製過程中還有許多輔助蛋白,E.coli就至少有15種。複製叉的複雜結構進一步提高複製準確性。
DNA複製還存在正調控和負調控,調控分子可以是蛋白質,也可以是RNA。
(一)複製叉由5’向3’方向連續複製,稱為前導鏈;另一條鏈複製叉由3’向5’移動,而DNA複製方向不變,形成許多不連續片段,稱為岡崎片段,最後連接成完整的DNA,稱為滯后鏈。
(二)首先由引物合成酶由5’向3’方向合成10個核苷酸以內的RNA引物,然後聚合酶III在引物3’-羥基上合成DNA,再由聚合酶I切除引物,填補空白,最後DNA連接酶將岡崎片段連接起來,形成完整DNA。
(三)複製具有高度忠實性,其錯配幾率約為10-10,從熱力學上考慮,鹼基發生錯配的幾率約為10-2,酶對底物的選擇作用和校正作用各使錯配幾率下降10-2,所以體外合成DNA的錯配幾率為10-6。體內複製叉的複雜結構提高了複製的準確性,修復系統對錯配加以糾正,進一步提高了複製的忠實性。
半不連續複製
DNA複製過程中,2條新生鏈都只能從5端向3端延伸,前導鏈連續合成,滯后鏈分段合成。這些分段合成的新生DNA片段稱岡崎片段。細菌岡崎片段長度1000-2000核苷酸,真核生物岡崎片段長度100-200核苷酸。在連續合成的前導鏈中,U-糖苷酶和AP內切酶也會在錯配鹼基U處切斷前導鏈.
任何一種DNA聚合酶合成方向都是從5'向3'方向延伸,而DNA模板鏈是反向平行的雙鏈,這樣在一條鏈上,DNA合成方向和複製移動方向相同(前導鏈),而在另一條模板上卻是相反的(后滯鏈)。那麼在複製叉中新鏈是如何合成的呢?1968年岡崎(Okazaki)及其同事進行了一系列實驗,回答了這一問題。
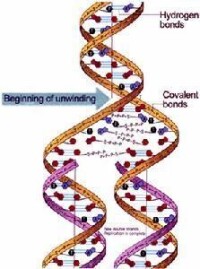
半不連續複製
1978年Olivera提出了半不連續(semidiscontinuous)複製模型,也就是說前導鏈上的合成是連續的,只有后滯鏈上的合成才是半連續的。
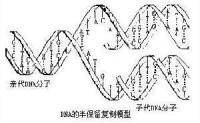
半不連續複製
(2)在ung-(尿嘧啶N-糖苷酶缺失)突變體中,新合成的DNA約有一半由片段組成。這是(3)因為尿嘧啶N-糖苷酶缺失,不會切除U的糖苷鏈,也就不會出現AP位點,所以鹼沉澱時不易斷裂,從而保持了半不連續的原貌。
在dut-,ung-雙突變體中,結果和實驗(2)相同,更進一步證實了此推測。
半保留複製(semiconservativereplication):一種雙鏈脫氧核糖核酸(DNA)的複製模型,其中親代雙鏈分離后,每條單鏈均作為新鏈合成的模板。因此,複製完成時將有兩個子代DNA分子,每個分子的核苷酸序列均與親代分子相同,這是1953年沃森(J.D.Watson)和克里克(F.H.C.Crick)在DNA雙螺旋結構基礎上提出的假說,1958年得到實驗證實。
1953年J.D.Watson和F.H.C.Crick在提出DNA雙螺旋結構時,對其互補關係予以很大的重視,而且提出了DNA的複製模型。DNA在進行複製時各以雙鏈中的每一條鏈作為模板,各個和互補的前體單核苷酸配對重合而形成與這二條單鏈各各對應的雙重子螺旋二條。所謂互補就是指腺嘌呤一定只與胸腺嘧啶配對,鳥嘌呤一定只與胞嘧啶配對,新的單核苷酸排列在模板上時,其排列法是依原來鏈上的鹼基通過互補來決定的。這樣無論子分子與子分子間,還是子分子與母分子間,鹼基排列順序是完全相同。這樣一來具有和親本完全一樣的遺傳信息的子分子自我增殖了二倍。這時所產生的子雙重螺旋分子一條鏈是從親代原封不動的接受下來的,只有相對的一條鏈是新合成的,所以把這種複製方式稱作半保留複製。這個模型曾用重同位素標記的DNA以密度梯度離心法進行分析,或用放射性同位素標記的DNA以放射自顯影法進行測定等等,用幾種不同原理的方法,曾在從人到病毒的許多種生物中進行了驗證,肯定了這個模型的正確性和普遍性。關於DNA是以半保留方式複製這一點已被認為是生物學中最基本的肯定性原理。
