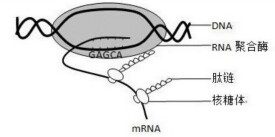
RNA聚合酶
多個蛋白亞基組成的複合酶
RNA聚合酶(RNA polymerase):以一條DNA鏈或RNA為模板催化由核苷-5′-三磷酸合成RNA的酶。是催化以DNA為模板(template)、三磷酸核糖核苷為底物、通過磷酸二酯鍵而聚合的合成RNA的酶。因為在細胞內與基因DNA的遺傳信息轉錄為RNA有關,所以也稱轉錄酶。
催化轉錄的RNA聚合酶是一種由多個蛋白亞基組成的複合酶。如大腸桿菌的 RNA聚合酶有五個亞基組成,其分子量為480000,含有α,β,β’,δ等4種不同的多肽,其中α為兩個分子,所以全酶(holoenzyme)的組成是α2ββ’δ。α亞基與RNA聚合酶的四聚體核心(α2ββ’)的形成有關;β亞基含有核苷三磷酸的結合位點;β’亞基含有與DNA模板的結合位點;而Sigma因子只與RNA轉錄的起始有關,與鏈的延伸沒有關係,一旦轉錄開始,δ因子就被釋放,而鏈的延伸則由四聚體核心酶(core enzyme)催化。所以,δ因子的作用就是識別轉錄的起始位置,並使RNA聚合酶結合在啟動子部位。細菌的RNA聚合酶,像DNA聚合酶一樣,具有很複雜的結構。其活性形式(全酶)為15S,由5種不同的多肽鏈構成,按分子量大小排列分別為β'(155000),β(151000),σ(7000),α(36500)和ω(11000)。每分子RNA聚合酶除有兩個α亞基外,其餘亞基均只有一個,故全酶為β'βα2σω(450000)
RNA聚合酶
σ亞基和其他肽鏈的結合不很牢固。當σ亞基脫離全酶后,剩下的β'βα2ω稱為核心酶。核心酶本身就能催化核苷酸間磷酸二酯鍵的形成,不論有無σ存在的利福平(rifampicin)和利福黴素(rifamycin)能結合在β亞基上而對此酶發生強烈的抑制作用。它抑制RNA合成的起始而不抑制其延長。β亞基的基因rpoB的突變可使細菌對利福平有抗性。而另一種抗生素鏈霉溶菌素(streptolydigin)能抑制RNA鏈的延長,rpoB的突變卻可使細胞對鏈霉溶菌素亦發生抗性。總的看來β亞基似乎是酶和核苷酸底物結合的部位。肝素能與DNA競爭與RNA聚合酶相結合。肝素是一種多價陰子,能和β'亞基結合,從而在體外抑制轉錄作用。可見β'亞基的鹼性較強,適於與模板DNA相結合。α亞基的功能現尚未知。然而,當噬菌體T4感染E.coli時,其α亞基即在精氨酸上被ADP-核糖化。這種修飾作用使該RNA聚合酶全酶對其原先識別的啟動子的親和力減弱。所以有人認為,α亞基的功能可能是識別其相應的啟動子。

RNA聚合酶
相比之下,宿主細胞的RNA聚合酶卻能轉錄細胞內的許多轉錄單位(>1000個)中的任意一個。這些轉錄單位中有一些可由RNA聚合酶直接轉錄,不需要其他因子的幫助。但大多數這些轉錄單位僅在更多的蛋白質因子存在下才能被該RNA聚合酶所轉錄。所以,可以想像宿主細胞所以要求這樣大和複雜,至少部分反映了它需要和許多其他因子相互作用,而不是其催化活性的固有的要求。
E.coli的RNA聚合酶各亞基的基因(除ω亞基的基因尚不詳外)均存在於三個操縱子中,這些操縱子還含有蛋白質合成和DNA合成所需的基因。P71主要啟動子(P)均在操縱子的左側,RNA則向右方合成。次要啟動子(p)包括σ操縱子中的一個啟動子(PHS,是在熱休克條件下才有活性的啟動子),均位於操縱子之內。這些次要啟動子僅啟動在其右側的基因。β操縱子的前面兩個基因L11和L1,有時被認為組成另一個獨立的操縱子,因為在L10基因之前另有一啟動子。這些基因編碼50個左右核糖體蛋白質中的某些蛋白質。σ操縱子中還含有複製所需的蛋白質,即DNA引物酶的基因。現在還不清楚這些操縱子是如何進行調節的。
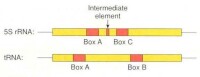
RNA聚合酶
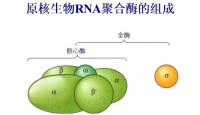
RNA聚合酶
以往研究表明,TL結構直接與新合成RNA的3'端和NTP相互作用,其中一個保守的組氨酸殘基直接與NTP底物相結合。Kaplan等人用其他氨基酸替代釀酒酵母RNA聚合酶Ⅱ中TL結構中的His1085殘基,結果導致釀酒酵母表現出嚴重的生長缺陷,甚至無法存活。離體實驗表明,His1085能夠選擇正確的NTP底物,該位點變異后,聚合酶Ⅱ摻入錯誤的NTP底物和2'dNTP底物的可能性大大增加。
α鵝膏覃鹼能夠抑制RNA聚合酶Ⅱ的延伸速率,降低其底物選擇性,但His1085被替代后的RNA聚合酶Ⅱ對α鵝膏覃鹼則具有較高的抗性。研究人員進一步研究了純化的RNA聚合酶-α鵝膏覃鹼複合體的晶體結構,發現α鵝膏覃鹼和TL結構間存在直接的相互作用。因此,研究人員認為,α鵝膏覃鹼通過直接作用於TL結構而降低RNA聚合酶Ⅱ的速率和保真度。
RNA聚合酶
T7是E.coli的烈性噬菌體,基因組長為39,936nt,順序已知。整個基因組可能具有55個基因,其中44個基因的產物已鑒別出了,已知30種是有功能的轉錄可分為3組,30°C整個生活周期約為25¢分鐘,但其DNA的注入很慢,整個的過程約10分鐘,而其它的噬菌體僅1分鐘即可完成。這也是一種調控的手段,因未注入宿主細胞中的DNA是不能轉錄的。在感染6分鐘后,E.coli的RNA合成體系全部被T4的合成體系所取代。
在感染后的前6分鐘,T7噬菌體的RNAPol尚未表達,因此仍使用了宿主E.coli的RNA聚合酶,轉錄的基因主要有10個(0.3,0.4,0.5,0.6,0.65,0.7,1,1.1,1.2,1.3),其0.3基因編碼宿主限制酶的抑制蛋白,使T7進入宿主免遭降解;0.7基因編碼一種蛋白激酶,能將E.coli的RNA聚合酶磷酸化,為抑制宿主RNAPol作準備;基因1編碼T7RNAPol聚合酶,分子量為98KDa,是一條單鏈肽,它所識別的啟動子是由23bp組成的保守順序(-17~16)。
晚期轉錄分為二組(Ⅱ和Ⅲ)。感染后6~12分鐘后T7就利用自己的RNA聚合酶轉錄第Ⅱ組轉錄物。這一組約含(1.4,1.5,1.6,1.7,1.8,2,2.5,2.8,3,3.5,3.8,4,5,5.7,6),其中對轉錄調控有關係的是基因2,其產物是E.coli聚合酶抑製劑。宿主的RNA聚合酶先受到基因0.7產物的磷酸化,再經抑制完全失去了作用,此時T7已不再需要I組的轉錄物了,因此廢除了宿主RNA聚合酶的功能,而將自己編碼的RNA聚合酶取而代之。第Ⅱ組的基因多與T7的複製酶系的合成及幾種結構蛋白有關,但第Ⅱ組的啟動子和複製的φL啟動子因其保守順序中分別有2~7個鹼基發生了改變,所以是較弱的啟動子,但由於其位置排在Ⅲ組啟動子的前面,所以先進入宿主得以轉錄,而不與第Ⅲ組啟動子的競爭。
RNA聚合酶
第Ⅰ組轉錄的終止位置在鄰近1.4基因的上游區(1.3和1.4之間),此是E.coliRNA聚合酶的終止子)它解離后T7RNA聚合酶則重新從第Ⅱ組起始轉錄。第Ⅱ組和第Ⅲ組都使用終止子Tj,由於自注入宿主緩慢,在第Ⅱ組轉錄時第Ⅲ組基因尚未注入,仍得不到表達。
Tj的終止效率是90%,尚有10%可以延長轉錄T7的末端,Tj位於基因10和11之間。基因10是主要的頭部蛋白,需要量大,它排在第Ⅱ組末是合理的,即有強啟動子的啟動,又在轉錄后被終止,這樣不僅滿足了裝配顆粒的需要,又不至造成浪費。而排在基因10後面的基因都是編碼少量頭部蛋白和尾部蛋白的,無需大量的轉錄,後面越過Tj延長轉錄的強度就可滿足需要了,這本身也是一種終止子對轉錄的調控。
RNA聚合酶
真核生物的RNA聚合酶分三類。RNA聚合酶Ⅰ存在於核仁中,轉錄rRNA順序。RNA聚合酶Ⅱ存在於核質中,轉錄大多數基因,需要“TATA”框。RNA聚合酶Ⅲ存在於核質中,轉錄很少幾種基因如tRNA基因如5SrRNA基因。有些重複順序如Alu順序可能也由這種酶轉錄。上面提到的“TATA”框又稱Goldberg –Hogness順序,是RNA聚合酶Ⅱ的接觸點,是這種酶的轉錄單位所特有的。它在真核生物的轉錄基因的5’端一側,在轉錄起點上游20至30個核苷酸之間有一段富含AT的順序。如以轉錄起始點為0,則在-33到27個核苷酸與-27至21核苷酸之間,有一個“TATA”框。一般是7個核苷酸。原核生物中也類似“TATA”框的結構。RNA聚合酶作用在“TATAAT”(Pribnow)盒和“TTGA-CA”框附近。
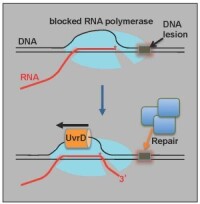
在美國著名哲學家愛默生(RalphWaldoEmerson)說“大自然容不得任何錯誤”的時候,他一定沒有考慮過RNA聚酶(RNApolymerase,RNAP),這一能將遺傳物質DNA與生物功能表現者蛋白聯繫起來的不二功臣實際上在轉錄的時候會發生很多錯誤,但是它也有“自知之明”會及時將這些錯誤更正過來。這一由Stanford大學StevenBlock實驗室完成的研究發表在11月Nature上面。
RNA聚合酶(RNAP),只要是稍微接觸過分子生物學的人就不會對這個名詞陌生,在DNA要將它的遺傳信息表達出去,成為真正具有功能效應的單位——蛋白的時候,需要中間體RNA的幫助,而要實現這個過程就不能缺少這個重要的酶。StevenBlock和他的同事利用一種比之前光阱(opticaltrap)更穩定的裝置發現在大腸桿菌轉錄的過程中,這個酶每隔大約1000個鹼基就會出現一個錯誤,但是RNAP也有良好的自我糾正機制,能及時發現和糾正這些錯誤。
RNA聚合酶
這一研究獲得了許多科學家的認可,德克薩斯大學健康中心的RuiSousa認為這是一項迄今為止最好的布朗荊輪的證明,但是也有科學家對此表示懷疑態度。
該酶需要四種核糖核苷酸三磷酸(NTP:ATP、GTP、CTP、UTP)作為RNA聚合酶的底物,DNA為模板,二價金屬離子Mg、Mn是該酶的必需輔因子。其催化的反應表示為:(NMP)n+NTP→(NMP)n+1+PPi。RNA鏈的合成方向也是5’→3',第一個核苷酸帶有3個磷酸基。其後每加入一個核苷酸脫去一個焦磷酸,形成磷酸二酯鍵,焦磷酸迅速水解的能量驅動聚合反應。與DNA聚合酶不同,RNA聚合酶無須引物,它能直接在模板上合成RNA鏈;RNA聚合酶能夠局部解開DNA的兩條鏈,所以轉錄時無須將DNA雙鏈完全解開,RNA聚合酶無校對功能。
RNA聚合酶催化RNA的合成,其與DNA聚合酶有許多相同的催化特點:
①以DNA為模板;
②催化核苷酸通過聚合反應合成核酸;
③聚合反應是核苷酸形成3’,5’一磷酸二酯鍵的反應;
④以3’→5’方向閱讀模板,5’→3’方向合成核酸;
⑤按照鹼基配對原則忠實轉錄模板序列。
通常可根據生物的類別,將RNA聚合酶分為原核生物RNA聚合酶、真核生物RNA聚合酶。
原核生物和真核生物的RNA聚合酶有共同特點,但在結構、組成和性質等方面又不盡相同。
(1)原核生物RNA聚合酶 研究得最清楚的是大腸桿菌RNA聚合酶。該酶是由五種亞基組成的六聚體(α2ββ'ωσ)分子量約500 000。其中α2ββ'ω稱為核心酶(coreenzyme),σ因子與核心酶結合后稱為全酶(holoenzyme)。
σ因子的主要作用是識別DNA模板上的啟動子,其單獨存在時不能與DNA模板結合,與核心酶結合成全酶后,才可使全酶與模板DNA上的啟動子結合。當它與啟動基因的特定鹼基序列結合后,DNA雙鏈解開一部分,使轉錄開始,故σ因子又稱起始因子。已經鑒定出大腸桿菌有7種σ因子,不同的σ因子可以競爭結合核心酶,以決定哪個基因被轉錄。其中σ(數字錶示其分子量大小)協助識別管家基因的啟動子。環境變化可以誘導產生特定σ因子,啟動特定基因的轉錄。
核心酶只有一種,參與整個轉錄過程,催化所有RNA的轉錄合成。
其他原核生物的RNA聚合酶在結構和功能上均與大腸桿菌相似。抗生素利福平或利福黴素可以特異抑制原核生物的RNA聚合酶,成為抗結核菌治療的藥物。它專一性地結合RNA聚合酶的β亞基。若在轉錄開始后才加入利福平,仍能發揮其抑制轉錄的作用,這說明β亞基足在轉錄全過程都起作用的。
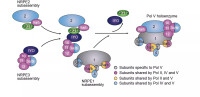
(2)真核生物RNA聚合酶 真核生物具有3種不同的細胞核RNA聚合酶,分別是RNA聚合酶I(RNA pol I)、RNA聚合酶Ⅱ(RNA pol II)和RNA聚合酶Ⅲ(RNA pol llI).這三種RNA聚合酶不僅在功能和理化性質上不同,而且對α一鵝膏蕈鹼(一種毒蘑菇含有的環八肽毒素)的敏感性也不同。
真核生物的3種細胞核RNA聚合酶的結構比原核生物複雜,3種RNA聚合酶都有2個不同的大亞基、2個類α亞基和1個類ω亞基,分別與大腸桿菌核心酶的β和β’、2個α亞基和ω亞基同源。除上述5個亞基外,三種RNA聚合酶還各含7~11個小亞基。合成RNA時,原核細胞依賴RNA聚合酶的各個亞單位就能完成轉錄過程,而真核細胞還需要一些蛋白質因子參與,並對轉錄產物進行加工修飾。
真核生物線粒體有自己的RNA聚合酶,催化合成線粒體mRNA、tRNA、rRNA。線粒體RNA聚合酶在功能和性質上與原核細胞RNA聚合酶類似,其活性也可被利福平或利福黴素抑制。