DNA聚合酶
細胞複製DNA的作用酶
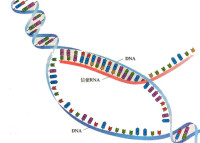
DNA聚合酶(DNA polymerase)是細胞複製DNA的重要作用酶。DNA聚合酶 , 以DNA為複製模板,將DNA由5'端點開始複製到3'端的酶。DNA聚合酶的主要活性是催化DNA的合成(在具備模板、引物、dNTP等的情況下)及其相輔的活性。
DNA聚合酶 , 以DNA為複製模板,從將DNA由5'端點開始複製到3'端的酶。 DNA聚合酶(DNA polymerase)的主要活性是催化DNA的合成(在具備模板、引物、dNTP等的情況下)
DNA聚合酶
在50年代的中期,A. Kornberg和他的同事們就想到DNA的複製必然是一種酶的催化作用,於是決心分離出這種酶並研究其結構和作用機制。為了達到這個目的,他們分離的蛋白,然後加到體外合成系統中即同位素標記的dNTP、Mg2+及模板DNA,經過大量的工作,於1956年終於發現了DNA聚合酶Ⅰ(DNA polymerase Ⅰ,DNA pol Ⅰ)原來稱為Kornberg酶。以後又相續發現了DNA pol Ⅱ和DNA pol Ⅲ。開始人們以為DNA pol I是細菌中DNA複製主要的酶類,後來發現DNA pol Ⅰ的突變株照樣可以複製,

DNA聚合酶

DNA聚合酶
聚合作用:在引物RNA'-OH末端,以dNTP為底物,按模板DNA上的指令由DNApolⅠ逐個將核苷酸加上去,就是DNApolⅠ的聚合作用。酶的專一性主要表現為新進入的脫氧核苷酸必須與模板DNA配對時才有催化作用。dNTP進入結合位點后,可能使酶的構象發生變化,促進3'-OH與5'-PO4結合生成磷酸二酯鍵。

DNA聚合酶

DNA聚合酶
DNA聚合酶
1、大腸桿菌DNA聚合酶Ⅰ(DNApolymeraseⅠ,DNApolⅠ)這是1956年由ArthurKornberg首先發現的DNA聚合酶,又稱Kornber酶。此酶研究得清楚而且代表了其他DNA聚合酶的基本特點。(1)理化性質:純化的DNApolⅠ由一條多肽鏈組成,約含1000個氨基酸殘基,MW為109KD。分子含有一個二硫鍵和一個-SH基。通過二個酶分子上的-SH基與Hg2+結合產生二聚體,仍有活性。每個酶分子中含有一個Zn2+,在DNA聚合反應起著很重要的作用。每個大腸桿菌細胞中含有約400個分子,每個分子每分鐘在37℃下能催化667個核苷酸摻入正在生長的DNA鏈。經過枯草桿菌蛋白酶處理后,酶分子分裂成兩個片段,
DNA聚合酶
DNA聚合酶
DNA聚合酶Ⅲ的組成
亞基 分子量(×103) 其它名稱
a 140 dnaE蛋白,polC蛋白
ε 25
θ 10
τ 83
γ 52 dnaZ蛋白
δ 32 dnaX蛋白
β 40 dnaN蛋白,copolⅢ
大腸桿菌三種DNA聚合酶的特性
功能 polⅠ polⅡ polⅢ
聚合作用5'→3' + +
外切酶活性3'→5' + + +
外切酶活性5'→3' + + +
焦磷酸解和焦磷酸交換作用 + - +
模板及引物的選擇
完整的DNA雙鏈 - - -
帶引物的長單鏈DNA + - -

DNA聚合酶
雙鏈而有間障的DNA + + +
一般性質
分子量 1 09KD 120KD >140KD
每細胞中的分子量 400 17-100 10-20
結構基因 polA polB polC
T4-DNA聚合酶(T4-DNApol):近年來在枯草桿菌,鼠傷寒沙門氏桿菌等細胞及噬菌體T4、T5、T7中分離到NDA聚合酶,這裡只介紹T4DNA聚合酶。T4DNA聚合酶與大腸桿菌DNA聚合酶Ⅰ相似,也是一條多肽鏈,分子量亦相近,但氨基酸組成不同,它至少含有15個半胱氨酸殘基。但是,它在作用上與大腸桿菌DNApol不同;它無5'→3'外切酶活性;它需要一條有引物的單鏈DNA作模板。在有缺口的雙鏈DNA作模板時,需要有基因32蛋白的輔助(基因32蛋白在T4DNA複製中的作用和大腸桿菌單鏈結合蛋白的作用相似,基因32蛋白在複製叉處和單鏈DNA結合后可以促進雙鏈的進一步打開,並保持其單鏈狀態有利於新生鏈的合成);它利用單鏈DNA為模板進,可同時利用它作為引物,即此單鏈DNA的3'端能環繞其本身的某一順序形成氫鍵配對,3'端的未雜交部分即被T4DNA聚合酶的3'→5'外切酶活性切去,然後在其作用下從3'-OH端開始聚合,合成該模板DNA的互補鏈,再以互補鏈為模板合成原來的單鏈DNA。
真核生物的DNA聚合酶:真核生物中也具有幾種DNA聚合酶,但這些聚合酶都沒有3'→5'或5'→3'外切酶活性。其聚合反應機制與原核生物的聚合一樣。主要的酶(佔總量的80-90%)是DNA聚合酶α,分子量為300KD,含有4個或5個亞基,主要負責染色體DNA的複製。DNA聚合酶β,
DNA聚合酶
1953年,沃森和克里克發表了經典論文,描述DNA的化學結構,而一些科學家對它的重要性提出了最初的質疑。兩人在論文中提出,DNA的複製原理仍有待確定。當時,美國生物化學家阿瑟·科恩伯格正在密蘇里州聖路易斯市的華盛頓大學微生物學系工作,他認可了這篇論文的重要意義。由此,他開始對機體合成核酸的過程產生了興趣,尤其是合成DNA。他在這些研究中使用的是相對簡單的大腸桿菌,1956年,他發現了裝配DNA基本單位的酶。這種酶被稱為DNA聚合酶Ⅰ,它以幾種不同的變體出現在所有的生物體中。科恩伯格在論文中描述了這些發現,他的論文起初不免遭拒,但之後於1957年被著名的《生物化學期刊》接受並發表。1959年,因為確定了“DNA的生物合成機制”,他成為諾貝爾獎的共同獲得者之一。
DNA聚合酶Ⅰ(pol Ⅰ)的發現對生物學研究有著非常重要的意義,因為它在生命過程中起著核心作用,令我們認識到DNA如何進行複製與修復。在細胞分裂之前,pol Ⅰ會複製細胞DNA的所有成分。接著,母細胞將其DNA副本傳遞給每一個子細胞,由此將遺傳信息代代相傳。科恩伯格發現pol Ⅰ能讀取完整的DNA鏈,並以之作為模板合成一條新鏈,後者與原DNA鏈完全相同——這個過程和複印機複製文件沒什麼區別。
不過,複印機在複製文件時是機械性的,它並不在乎文件的內容,與此不同的是,DNA聚合酶7個子類中的某些成員能夠校對原始DNA模板,偵查、移除並改正錯誤,從而生產出一條無誤的新DNA鏈,這其中就包括DNA聚合酶Ⅰ。其他的DNA聚合酶只能複製不能修復,因此它們能夠保留基因組中的突變,或是令細胞死亡。
DNA聚合酶有多種,E.coli就有三種。通常DNA聚合酶具有以下共同特點:
①需要DNA模板,因此這類酶又稱為依賴DNA的DNA聚合酶;
②需要RNA或DNA作為引物(primer),即DNA聚合酶不能從頭催化;
③催化dNTP加到引物的3'-OH末端,其速率為1000nt/min,因而DNA合成的方向是5’到3';
④三種DNA聚合酶都屬於多功能酶,它們在DNA複製和修復過程的不同階段發揮作用。
原核生物
大腸桿菌DNA聚合酶DNA聚合酶最早在E.coli中發現,到目前為止已確定有5種類型,分別為DNA聚合酶Ⅰ、DNA聚合酶Ⅱ、DNA聚合酶Ⅲ、DNA聚合酶Ⅳ和DNA聚合酶V,都與DNA鏈的延長有關。
其中DNA聚合酶I、Ⅱ、Ⅲ研究得比較明確。
DNA聚合酶Ⅰ是1956年由Arthur Komberg在E.coli中首先發現,是一種多功能酶,有三個不同的活性中心:
①5’一3’聚合酶活性催化DNA鏈的延伸,主要用於填補DNA上的空隙或是切除RNA引物后留下的空隙;
②3’一5’外切酶活性能識別和切除DNA 3’端在聚合作用中錯誤配對的核苷酸,起到校讀作用;
③5’一3’外切酶活性主要用於切除5’引物或受損傷的DNA。此酶缺陷的突變株仍能生存,表明DNA聚合酶I不是DNA複製的主要聚合酶。
DNA聚合酶Ⅱ是一種多酶複合體,有5’—3’聚合酶活性中心和3’—5 ’外切酶活性中心,但沒有5 ’—3’外切酶活性中心。其催化5’—3’方向合成反應的活性只有DNA聚合酶Ⅰ的5%。因該酶缺陷的E.coli突變株的DNA複製都正常,所以也不是DNA複製的主要聚合酶,可能是在DNA的損傷修復中起到一定的作用。
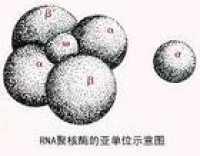
DNA聚合酶Ⅲ是一種多酶複合體,全酶由α、β、γ、δ、ε、θ、τ、χ和ψ中共10種亞基構成,其中α、ε和θ亞基構成全酶的核心。α亞基含5’—3’聚合酶活性中心,ε亞基含3’一5’外切酶活性中心,θ亞基可能起裝配作用,其他亞基各有不同作用。DNA聚合酶Ⅲ活性最高,在DNA複製鏈的延長上起著主導作用,是催化DNA複製合成的主要酶。
DNA聚合酶Ⅳ和V發現於1999年,主要參與DNA修復。
真核生物
真核生物DNA聚合酶真核生物中已發現十幾種DNA聚合酶,常見的有α、β、γ、δ和ε五種,均具有5’—3’聚合酶活性。DNAα聚合酶僅負責合成引物,DNAδ聚合酶用於合成細胞核DNA,DNA聚合酶β和DNA聚合酶ε主要參與DNA損傷修復,DNA聚合酶τ用於線粒體DNA的合成。
DNA複製的保真性是遺傳信息穩定傳代的保證。生物體至少有3種機制實現保真性:
①遵守嚴格的鹼基配對規律;
②5’—3’聚合酶活性中心對底物的選擇,使核苷酸的錯配率僅為10~10;
③3’—5’外切酶活性中心在複製出錯時的即時校對,使錯配率降至10~10。
E.coli的DNA pol Ⅰ涉及DNA損傷修復,在半保留複製中起輔助的作用。DNA polⅡ在修復損傷中也具有重要的作用。DNA polⅢ是一種多亞基的蛋白質,在DNA新鏈的從頭合成中起複制酶的作用。
複製的忠實性問題會影響到翻譯的精確性,這種忠實性主要依賴於鹼基的特異性配對。據估計每個鹼基對應的將有10個。的概率會發生錯配,但實際的錯配率只有10~10,即每1000個細菌複製周期中,每個基因組只產生一次錯誤。DNA多聚酶能增加互補鹼基的特異性,該特異性主要表現在以下兩方面:
①能夠檢查進入的鹼基是否和模板互補,這時通過一個匹配的化學特點加以識別,這是合成前的一種預防措施,稱為合成前( presynthetic)錯誤控制;
②在新的鹼基加到鏈上以後,檢查鹼基是否配對。若發生錯配,將會把剛加上去的錯誤鹼基切除掉,這是校正控制( proofreading)。
細菌的三種DNA聚合酶都具有3 7硝’外切活性,逆DNA合成方向進行加工,提供校對功能。在鏈的延伸階段中,一個核苷酸進入生長鏈的末端,形成鍵,該酶就向前移一個鹼基對,準備下一個鹼基對的進入。若一個錯誤產生了,這個酶就向回退,切除最後加進來的這個鹼基,產生一個位點,然後被正確的鹼基取代。
不同DNA多聚酶聚合和校正之間的關係是不同的。有時,這些活性是由相同的蛋白質亞基產生的,但有時它們又還有不同的亞基。一個錯誤鹼基地排除實際上是十分複雜的,因為這種切除反應是由不同位點催化的。
