碳酸
低沸點酸、可溶於水的二元弱酸
碳酸[tàn suān](H₂CO₃)是一種二元弱酸,電離常數都很小。但也有認為其為中強酸,因為根據無機酸酸性強弱判斷式(OH)nROm可判斷其酸性與磷酸相似。在常溫、常壓下,二氧化碳飽和溶液的濃度約為0.033mol/L,pH為5.6,pKa=6.37。
化學式為H2CO3,電離常數都很小。在常溫、常壓下,二氧化碳飽和溶液的濃度約為0.033mol/L,pH為5.6,pKa1=6.37,pKa2=10.32。
H2CO3(pKa1=6.38,pKa2=10.33,p代表取負常用對數。)飽和碳酸溶液(純CO₂,壓力為1atm)的pH約為4,而在自然條件下CO₂含量是0.03%,溶解達到飽和時pH=5.6。這也是為什麼定義酸雨為pH小於5.6的雨水的原因。要使PH達到3.7,可以通過降溫,加壓(實際是提高CO₂濃度)來實現。
會使紫色石蕊試液變成梅紅色,碳酸顯酸性,酸可使紫色石蕊變色。二氧化碳在溶液中大部分是以微弱結合的水合物形式存在,只有一小部分形成碳酸(H₂CO₃)——飽和CO₂溶液中只有1%的CO2與H2O化合成碳酸。在常溫時,CO2∶H2CO3為600∶1。碳酸的熱穩定性很差。碳酸加熱時全部分解並放出二氧化碳。碳酸在鹼的作用下,能生成酸式碳酸鹽M(HCO3)2和碳酸鹽MCO3〔M代表二價金屬)。暫時硬水加熱軟化就是因為生成了碳酸鹽沉澱。所有的酸式碳酸鹽受熱均分解為CO2和相應的正鹽。碳酸是二氧化碳氣體溶於水而生成的酸。它的酸性很弱,且極為不穩定,溫度稍高一些,便會分解成二氧化碳和水。碳酸和我們的日常生活有著密切的關係。我們喝的汽水就是一種碳酸飲料。
在製造汽水時,要在加壓情況下把二氧化碳氣體溶解在水裡,再往汽水裡加糖、檸檬酸以及果汁或香精,在加壓下灌入汽水瓶中。當我們喝汽水時,汽水從瓶子里倒出來,外界壓強(指空氣壓強和人體內的壓強)突然降低,二氧化碳在水中的溶解度隨著壓強降低而變小。於是,喝入體內汽水中的二氧化碳便成為氣體從水中逸出,並從口腔中排出,這個過程會把人體內的熱量帶走,這就是喝汽水感到涼爽的原因。
已製備出純碳酸(碳酸晶體),但條件非常苛刻,要保存在絕對無水的條件下,不然純碳酸會劇烈分解。
物理性質
碳酸酸性極低,其飽和水溶液pH約為5.6,其水溶液顯酸性故可以使指示劑變色(可以使石蕊溶液變紅色)。
化學性質
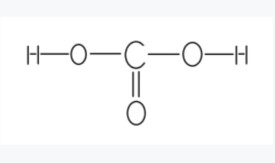
結構簡式:HO—CO—OH在CO₂溶於水時形成。
純的碳酸以C(OH)4存在是個不穩定的晶體,遇水劇烈分解。
碳酸是一種二元酸,其電離分為兩步:
H₂CO₃⇌HCO₃+H;Ka1=4.2×10mol/L;pKa1=6.38(25°C)
HCO3⇌CO3+H;Ka2=5.61×10mol/L;pKa2=10.25(25°C)
需要注意的是,以上所述值並不適用於實際估算碳酸的酸性,因為單個碳酸分子的酸性比醋酸和甲酸都要強。實際上,碳酸分子只出現在二氧化碳和水的動態平衡中,其濃度比二氧化碳低得多,故酸度實際上較低。
化學反應
生成和分解
CO2溶於水生成碳酸,方程式為:CO2+H2O⇌H2CO3
碳酸不穩定、易分解,分解生成CO2和H2O,方程式為:H2CO3⇌H2O+CO2↑
兩種情況同時存在,達到動態平衡,方程式用“⇌”表示
在實驗室里,二氧化碳常用稀鹽酸與大理石(或石灰石,主要成分都是碳酸鈣)反應來製取。反應的化學方程式可以表示如下:
三維模型
CaCO3+2HCl=CaCl2+H2CO3(兩種化合物互相交換成分)
碳酸不穩定容易分解成二氧化碳和水H₂CO3⇌H2O+CO2↑
總的方程式是:
CaCO₃+2HCl=CaCl2+H2O+CO2↑(反應有氣體和水生成)
酸性
碳酸是二元弱酸,會分步電離,有微腐蝕性。
H2CO3⇌HCO3+H
HCO3⇌CO3+H
碳酸顯酸性,會使紫色石蕊試液變成紅色。二氧化碳在溶液中大部分是以微弱結合的水合物形式存在,只有一小部分形成碳酸(H2CO3)——飽和CO2溶液中只有1%的CO2與H2O化合成碳酸。在常溫時,CO2:H2CO3為600:1。碳酸的熱穩定性很差。碳酸加熱時全部分解並放出二氧化碳。碳酸在鹼的作用下,能生成酸式碳酸鹽M(HCO3)2和碳酸鹽MCO3(M代表二價金屬)。許多金屬的酸式碳酸鹽的溶解度稍大於正鹽,其溶解度和Pco2(二氧化碳分壓)有關。Pco2大,碳酸鹽溶解於水;Pco2小(或升溫),析出碳酸鹽,自然界的鐘乳石就是這樣形成的。硬水加熱軟化就是因為生成了碳酸鹽沉澱。所有的酸式碳酸鹽受熱均分解為CO2和相應的正鹽。
已製備出純碳酸(碳酸晶體),但條件非常苛刻,要保存在絕對無水的條件下,不然純碳酸會劇烈分解。
碳酸是二元弱酸,會分步電離,有微腐蝕性。
H2CO3⇌HCO3+H
HCO3⇌CO3+H
大量喝可樂時,可樂里的磷元素會引起人體內鈣、磷代謝失調,影響體內鈣的吸收。
有時,碳酸也會給日常生活帶來麻煩。地面上的二氧化碳氣體溶於水,生成碳酸。當地面水滲入地下時,碳酸也被帶到地下,並與地下石灰岩里不溶於水的碳酸鈣發生化學反應,生成可溶於水的碳酸氫鈣。含有碳酸氫鈣的水稱為“硬水”,因此地下水都屬於“硬水”。江河裡的水不含碳酸氫鈣,不是“硬水”(硬水是指有較多鈣離子和鎂離子等金屬陽離子,它們的碳酸鹽是不可溶解於水的)。
有些地方所用的自來水的水源是地下水,在煮開水時,水中的碳酸氫鈣受熱分解成碳酸鈣、二氧化碳和水。碳酸鈣是不溶解在水中的沉澱物,它沉積在水壺和鍋爐的壁上,天長日久便成為一層白色的很堅硬的物質,稱為鍋垢(俗稱水鹼)。這層碳酸鈣的導熱性很差,因此燒水時會浪費燃料。如果鍋爐和管道中的鍋垢太厚,還有發生爆炸的危險。所以,工業生產中總是把“硬水”先用化學方法除去或減少碳酸鈣,使它軟化以後再用。

碳酸
碳酸是有機物還是無機物是科學界爭執了很長時間的話題。由於同一個碳原子上連接了兩個羥基,碳酸不穩定,更多顯現無機物的性質,定義碳酸為無機二元弱酸,但碳酸又因含有羧基(-COOH)而能反映一些羧酸的性質。如能和醇發生酯化反應,
如:HO-COOH+H-O-C2H5→HO-COOC2H5+H2O
HO-COOC2H5+H-O-C2H5→C2H5OCOOC2H5+H2O
因為碳酸的兩個羥基都結在羰基上,故相當於二元羧酸。可以和二元醇發生酯化反應生成環酯和聚酯。
這些都是有機酸的性質。
科學家仍然對碳酸是否是有機酸爭執。有科學家認為如能製得碳酸的濃溶液,那麼這種碳酸具有一切二元羧酸的性質。