奧利弗·史密斯
奧利弗·史密斯
奧利弗·史密斯(英語:OliverSmithies,1925年7月23日-)是英國出生的美國遺傳學家,北卡羅來納大學教堂山分校教授。因發明基因敲除小鼠技術與美國科學家馬里奧·卡佩奇和英國科學家馬丁·埃文斯一起獲得2007年諾貝爾生理學或醫學獎。
1925年7月23日,史密斯出生於英格蘭西約克郡的哈利法克斯,父親是一家保險公司的推銷員,母親是一所技術學院的教師。史密斯很小就擁有較強的動手能力,他的大部分時間用於自己製造一些儀器,如使用豬的膀胱製備成為擴音器,此外還製造瞭望遠鏡和無線電等。史密斯在高中階段的成績非常優秀,因此畢業時獲得了一項獎學金而有機會進入牛津大學的貝列爾學院學習,並以優異成績在1946年獲得生理學學士學位,此外大學期間還獲得化學的第二學位。隨後繼續在牛津大學進行研究生學習,期間試圖通過測量滲透壓來檢測蛋白質之間的相互作用,儘管最後發現該方法在研究中沒有一點實際意義,但通過這些訓練,培養了自己執著的科研精神。
1951年,史密斯獲得了哲學博士學位,他的導師建議史密斯去國外特別是美國進行進一步研究以擴大自己的知識體系。1951年史密斯來到美國,進入威斯康星-麥迪遜大學生理化學實驗室進行博士后研究,期間主要進行蛋白質分離方面的工作。1953年史密斯在多倫多大學獲得了一個職位,進入醫學研究實驗室成為研究助手。
史密斯主要進行胰島素的研究工作,,他發現當時的自由電泳在製備純凈蛋白質過程中存在很大的困難,需要將該方法進行改進。史密斯首先將充滿的澱粉粒作為電泳介質進行蛋白質分離,雖然效率有所提高,但該方法費時費力,無法大規模應用。此時史密斯回憶起小時候在澱粉進行加熱后冷卻可以製成果凍樣物質,可以成為電泳很好的支持物,隨後對自己的想法進行實驗並最終獲得了理想的凝膠,該方法一方面使蛋白質的解析度大大提高,另一方面也大大節約了時間。雖然史密斯當時沒有意識到發現的重要性,但不久就發現澱粉凝膠電泳(Starchgelelectrophoresis,SGE)成為第一個高解析度的電泳技術,在深入分離研究蛋白質的過程中發揮了重要作用,如史密斯使用自己發明的方法發現健康人群中的血清蛋白在氨基酸組成上存在一定的差異,從而促進了蛋白質多態性的發現。SGE在早期進行蛋白質遺傳突變研究方面發揮了巨大的作用,為一些新蛋白質如轉鐵蛋白、g-球蛋白等的發現作出了重要的貢獻,特別是隨後科學家通過改進支持介質而擴大了凝膠電泳的應用範圍,成為今天實驗室研究蛋白質和核酸的基本方法。史密斯由於這項研究而獲得了1964年的威廉艾倫紀念獎和1990年的蓋德納爾基金會國際獎。
1960年,史密斯回到了威斯康星大學,成為遺傳學和醫學遺傳學助理教授,並於1971年成為講座教授。史密斯在60年代主要完善自己的電泳和進行蛋白質的研究,在蛋白質多態性和抗體多樣性方面都有一系列重要的發現,從而贏得了同行的尊敬。史密斯1971年當選為美國科學院院士,1978年成為美國藝術和科學院院士,1975年還成為了美國遺傳學會主席。

基因打靶著作
史密斯由於在基因剔除研究中的奠基性貢獻而獲得了許多重要的國際獎勵(大多數和卡佩奇分享),比較著名的如1993年蓋德納爾基金會國際獎(史密斯成為極少兩獲該項獎勵的科學家之一)、2002年拉斯克基礎醫學獎(有美國諾貝爾獎之稱)、2002/2003年沃爾夫醫學獎、2005年的MarchofDimes發育生物學獎等,因此史密斯和卡佩奇將是近幾年諾貝爾生理與醫學獎最熱門的人選。
1988年,史密斯由於學生也是後來他的妻子梅伊達(NobuyoMaeda)在位於查布爾希爾的北卡羅萊納大學醫學院獲得了一個職位,因此他也隨後來到這裡並成為病理學和實驗醫學的教授,繼續進行自己的研究。史密斯利用自己發明的基因剔除技術對多種哺乳動物基因進行了研究,並以小鼠為材料建立了囊性纖維化、b-地中海貧血和高血壓等許多人類疾病的理想模型。史密斯尤其對高血壓的發生機理進行了全面的研究,認為血壓的變化受到多個不同基因的調控,而每一個基因僅發揮微調的效應,因此,史密斯現在的任務是尋找最為重要的一個或幾個基因,從而為高血壓的有效治療提供更為有效的保證。
史密斯無疑是一位偉大的科學大師,在半個多世紀的研究中為生命科學尤其是遺傳學的發展做出了巨大的貢獻,發明的凝膠電泳和基因剔除技術已經成為研究中不可缺少的工具,尤為值得讚揚的是在60歲時還做出了重大的科學發現——基因剔除技術,這是因為史密斯對科研充滿了極大的熱情,在70多歲的時候,仍然堅持一周7天每天很早就來到實驗室,仍然精力旺盛地進行著生命科學的研究。
史密斯於1998年當選為英國皇家學會的外籍會員,此外還曾經擔任多家科學協會的主席,儘管已經80高齡,但仍然在自己喜愛的科學領域進行著執著的探索,以揭開許多生命問題的奧秘。
遺傳學是一門科學,專門研究生物體的遺傳與變異。遺傳學最早的應用在有歷史記載之初就已經出現了,即馴養動物及植物的選擇育種。遺傳信息以化學方法被編碼在DNA(脫氧核糖核酸)中。基因組學是研究特定物種所有DNA的學科。
直到1865年,才由格里哥·孟德爾首先記錄了豌豆某些特性的遺傳模式,表明它們遵守簡單的統計學規律。雖然並不是所有的特性都顯示出這種孟德爾遺傳,他的工作說明將統計學應用於遺傳將會有很大幫助。從那時起,出現了許許多多更複雜的模式。由他的統計分析中,孟德爾定義了一個概念:遺傳的基本單位——等位基因。他描述的等位基因類於現在的基因。而現在等位基因的意思是一個特定基因的特定實例。直到孟德爾死後,20世紀初另外的科學家重新發現這個定律之後,孟德爾的工作的重要性才被大家了解。
孟德爾沒有發現基因的物理性質。現在我們知道遺傳信息通常是由DNA攜帶的(某些病毒的遺傳信息儲存在RNA中)。操縱DNA可以隨之改變生物的遺傳性狀。這些基因包含了製造蛋白質的信息,蛋白質最終導致了生物表型的變化。以某種觀點看來,在分子層面上,生命被定義為RNA多聚核苷酸使得自身延續的一組策略。這個定義基於RNA世界假說。由生物化學和遺傳學聯合所發展出的科學叫做分子生物學。改變一個生物的DNA從而達到某種目的被稱為基因工程。不與DNA/RNA嚴格相關的研究遺傳特性的學科叫做實驗胚胎學。

諾貝爾獎獎章
諾貝爾在其遺囑中所提及的頒獎機構是:位於斯德哥爾摩的瑞典皇家科學院(物理學獎和化學獎)、皇家卡羅林外科醫學研究院(生理學或醫學獎)和瑞典文學院(文學獎),以及位於奧斯陸的、由挪威議會任命的諾貝爾獎評定委員會(和平獎),瑞典科學院還監督經濟學的頒獎事宜。為實行遺囑的條款而設立的諾貝爾基金會,是基金的合法所有人和實際的管理者,並為頒獎機構的聯合管理機構,但不參與獎的審議或決定,其審議完全由上述4個機構負責。每項獎包括一枚金質獎章、一張獎狀和一筆獎金;獎金數字視基金會的收入而定。經濟學獎的授予方式和貨幣價值與此相同。
評選獲獎人的工作是在頒獎的上一年的初秋開始的,先由發獎單位給那些有能力按照諾貝爾獎章程提出候選人的機構發出請柬。評選的基礎是專業能力和國際名望;自己提名者無入選資格。候選人的提名必須在決定獎項那一年的2月1日前以書面通知有關的委員會。

諾貝爾
如果沒有人能符合諾貝爾遺囑中所要求的那些條件或世界局勢有礙於收集評選資料時(如第一次世界大戰期間和第二次世界大戰期間),則將獎保留或停止頒獎。該獎對所有的人開放,不論其國籍、種族、宗教信仰或意識形態如何。同一獲獎者可以多次獲獎而不受限制。物理學、化學、生理學或醫學、文學以及經濟學的頒獎儀式在斯德哥爾摩舉行,而和平獎的頒獎儀式則在奧斯陸舉行,時間為12月10日,即諾貝爾逝世周年紀念日。獲獎者通常親自去受獎。
支配獎項的總則已載於諾貝爾的遺囑中。1900年,由遺囑執行人、頒獎單位的代表及諾貝爾家族共同就解釋和執行遺囑的補充規定達成協議,並由瑞典國王在樞密會議上予以批准。這些規章大體上保持不變,僅在實際應用上有些修改;評議經濟學獎的基礎是科學的,即數學的或統計學的,而不是政治的或社會的。最早兩名經濟學獎獲得者經濟學家弗里希和丁伯根,因他們在計量經濟學方面的工作,即利用數學式進行的經濟活動分析而被授予該獎。
美國科學家馬里奧·卡佩基、奧利弗·史密斯和英國科學家馬丁·埃文斯這3位獲獎科學家,利用“基因靶向”技術讓小鼠體內的特定基因失去活性,培養出研究價值極高的“基因敲除”小鼠。英國著名科普雜誌《新科學家》網站8日推出特別報道指出,“基因靶向”技術的重要性是使任意改變小鼠基因變為現實。其為人類遺傳病研究提供了藥物試驗的動物模型。有了這些動物模型后,人類就能更有效地找到治療各種遺傳病的新療法,徹底攻克遺傳病就為時不遠了。

埃文斯、卡佩基和奧利弗·史密斯
雖然“基因靶向”技術如今廣受重視,但它起步比較晚,20世紀80年代初才發展起來。1981年,時任英國卡的夫大學哺乳動物基因學教授的英國科學家馬丁·埃文斯,首次從老鼠胚胎中提取出胚胎幹細胞(ESC),當時他還未意識到這對人類遺傳病研究的重大意義。胚胎幹細胞指的是在人胚胎髮育早期未分化的細胞,具有細胞全能性,可以分化、發育成完整的動物個體。美國科學家馬里奧·卡佩基、奧利弗·史密斯,在獲悉埃文斯的研究成果后如獲至寶,他們有了全新的想法——對胚胎幹細胞進行基因改造,這就導致了“基因敲除”小鼠的出現。
科學家們設想,讓生物體內一部分不活躍、功能未知的基因“沉默”,以找出遺傳病的罪魁禍首。這一點其實也不難理解,英國科學家埃文斯就曾用一個生動的例子形容這個過程:一個樂團正在演出,卻混進了一個技藝不精的濫竽充數者。他的出現使得樂團的整體表現嚴重下降。怎樣將他揪出來呢?最好的辦法是,讓“生面孔”停止演出,如果演出質量沒有多大變化,那麼他就不是要找的那個人。如果演出能恢復到先前的水平,那麼被揪出的那個人就是問題的根源。對科學家們來說,人體就像一個樂團,致病基因的出現打亂了正常秩序,需要找到應對之策。
隨著“基因靶向”技術的日漸成熟,科學家能成功地將小鼠體內的某些基因“敲除”,這就是後來的“基因敲除”小鼠。具體做法是,先通過基因重組的辦法,對小鼠胚胎幹細胞進行基因修飾——將胚胎幹細胞中的靶向基因改掉,然後將“修飾”后的胚胎幹細胞植入小鼠的早期胚胎,生成嵌合體小鼠。這種小鼠長大后,體內部分細胞內存在被修飾過的DNA片段,而一些可疑基因已經被“敲”掉了。如果“敲掉”小鼠生殖細胞里的目標基因,則出生后的小鼠體內所有的細胞都是被“修飾”過的。
1989年,科學們培育出了首隻“基因敲除”小鼠,他們通過多次“敲”,在小鼠體內發現了導致萊一二氏症(又稱自毀容貌綜合症,屬X-連鎖隱性遺傳)的基因。迄今為止,科學家們已培育了500多種存在不同基因變異的小鼠,總數超過一萬隻,這些變異小鼠對應的人類疾病包括心血管疾病、糖尿病和癌症等。
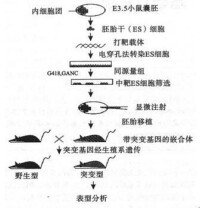
基因打靶
在眾多科研人員的努力下,“基因靶向”技術也發展到了相當成熟的地步,科學家們已能讓基因突變在小鼠生長的特定時間、特定細胞或器官內發生。這就好像狙擊手佔據絕對主動的地位,能在合適的時候對目標發起致命一擊。英國科學家埃文斯發展了自己先前的研究成果,和合作者成功地將人類遺傳性肺病、囊腫性纖維化基因移植到了小鼠身上。史密斯領導的研究小組讓高血壓、動脈疾病基因在小鼠體內得到了表達。
美國《紐約時報》分析指出,“基因靶向”技術對人類治療遺傳病起到了至關重要的作用。該報援引一位資深研究人士的話說,小鼠基因系列與人類相似度達95%,兩者的器官也幾乎一致,小鼠就相當於“口袋大小的袖珍人”。

基因打靶設備
胚胎幹細胞研究終於獲得了世界最高科學獎的肯定,這讓科學家們看到了希望。由於提取人類胚胎幹細胞需要破壞早期胚胎,很多人權組織及宗教團體極力反對。美國政府也在重重壓力之下減少了這一領域的科研經費,美國總統布希曾多次對幹細胞法案說“不”。美國人類基因研究所的研究人員利勒·阿姆斯特朗樂觀地表示:“或許布希總統不會改變決定,但未來聯邦政府也許為胚胎幹細胞研究設立專項基金。”
史密斯在學校只有一小間辦公室,而且與他的妻子合用。睡夢中被瑞典卡羅林斯卡醫學院諾貝爾生理學或醫學獎評審委員會告知獲獎消息的電話鬧醒後幾個小時,他又開始日常工作。
一定程度上,對史密斯贏得全球生理學和醫學界最高獎項,眾多同事似乎比他本人更為興奮,不時進入他的辦公室,打斷他的工作,向他表示祝賀。醫學院副院長埃塔·皮薩諾說,史密斯獲獎是一件可喜的事情。按照他的判斷,“毫無疑問,(史密斯的)這項研究工作將促成全新療法,適用於所有有著基因緣由的疾病”。史密斯與美國猶他大學人體基因學和生物學教授馬里奧·卡佩基和英國加的夫大學哺乳動物遺傳學教授馬丁·埃文斯一道,因開創“基因靶向”技術而成為本年度諾貝爾生理學或醫學獎得主。
史密斯:“我的工作從來不是為了獲得諾貝爾獎……而是解決某個問題,然後享受解決方案。”
利用胚胎幹細胞改造老鼠體內的特定基因
當天下午,北卡羅來納大學校方在史密斯所在的癌症研究中心舉辦一場招待會,以示對他獲獎的慶賀。會上,大家為史密斯歡呼和鼓掌。史密斯局促不安,不止一次要求大家停止鼓掌。
招待會前舉行的新聞發布會上,史密斯為自己的低調作出解釋:“我不必等待(研究)發現(得到認可)才感到高興。”
過去19年間,史密斯一直任職於北卡羅來納大學查珀爾希爾分校。北卡羅來納大學校長詹姆斯·默澤評價道,“幾十年間,他(史密斯)以謙遜、幽默、創造力和發明熱誠,展示了學術研究和人文精神的最高境界”。
所謂“最高境界”,按照默澤的解釋,是史密斯在研究和教學工作中身體力行,“以他的榜樣作用,讓數以百計的學生和同事懂得,如何以研究工作幫助這個世界”。
“基因靶向”技術以實驗鼠為施用對象,創製人體先天遺傳疾病或遺傳變異所致疾病的“模型”,提供開發新療法的參照。
史密斯歷年從事的研究項目涉及帶有遺傳因素的高血壓等疾患。他說,“我總是希望有助於(治療)常見疾病,而不是罕見疾病,例子之一就是研究與高血壓相關的課題”。
