還原性糖
具有還原性的糖類
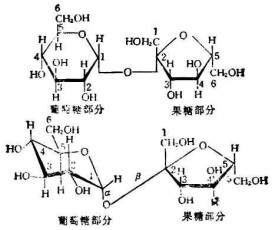
斐林試劑以及由檸檬酸、硫酸銅與氫氧化鈉配製的本尼迪特試劑(班氏試劑)常與醛糖及酮糖在水浴加熱的條件下反應產生氧化亞銅磚紅色沉澱,即試劑本身被還原,所以凡能與上述試劑發生反應的糖稱為還原糖(reducing sugar),凡不能與上述試劑發生反應的糖稱為非還原糖(non reducing sugar),糖苷不能發生上述反應。葡萄糖分子中含有遊離醛基,果糖分子中含有遊離酮基,乳糖和麥芽糖分子中含有遊離的醛基,故它們都是還原糖。
非還原性糖有蔗糖、澱粉、纖維素等,但它們都可以通過水解生成相應的還原性單糖。
能夠還原斐林(H.von Fehling)試劑(本尼迪特試劑)或托倫斯(B.Tollens)試劑的糖稱為還原糖,所有的單糖(除二羥丙酮),不論醛糖、酮糖都是還原糖。大部分雙糖也是還原糖,蔗糖例外。斐林試劑是含Cu2+絡合物的溶液,被還原后得到磚紅色Cu2O的沉澱。托倫斯試劑被還原后能生成單質銀,發生“銀鏡反應”。
分子結構中含有還原性基團(如遊離醛基或遊離酮基)的糖,叫還原糖。如葡萄糖。
果糖含有遊離的酮基,所以果糖也屬於還原糖。
如該糖是酮糖,羰基就會斷裂,分解成兩個較小的分子,如果糖。
所有單糖(除二羥丙酮)及大部分二糖(除蔗糖等)在本尼迪克特試驗中呈陽性反應,所以大部分單糖及二糖都具有還原性。
還原糖與斐林試劑發生作用,可以生成磚紅色沉澱。
斐林試劑(主要由質量濃度為0.1g/mL的NaOH溶液和質量濃度為0.05g/mL的CuSO4溶液配製而成)
注意:現配現用
植物組織是常用的實驗材料,但必須加以選擇。本實驗最理想的實驗材料是含糖量較高的生物組織(或器官),而且組織的顏色較淺,或近於白色的,如蘋果和梨的果實。經試驗比較,顏色反應的明顯程度依次為蘋果、梨、白色甘藍葉、白蘿蔔。
①向試管內注入2mL待測組織藥液
②向試管內注入1mL斐林試劑(甲液和乙液等量混合均勻后再注入)
③將試管放入盛有50~65℃溫水的大燒杯中加熱約2min
④觀察試管中出現的顏色變化
斐林試劑和班氏試劑等都是檢驗還原性糖的試劑,二者的使用方法及原理、成分有區別。下面就從這幾種試劑的使用原理、成分及使用方法等方面做一簡單總結。
1.斐林試劑和雙縮脲試劑
斐林試劑和雙縮脲試劑都由NaOH溶液和CuSO4溶液組成,但二者有如下三點不同:
(1)溶液濃度不同
斐林試劑中溶液為斐林試劑甲(NaOH溶液)其濃度為0.1g/ml,斐林試劑乙(CuSO4溶液)其濃度為0.05g/ml;雙縮脲試劑:雙縮脲試劑A(NaOH溶液)的濃度為0.1g/ml,雙縮脲試劑B(CuSO4溶液)的濃度為0.01g/ml。
(2)使用原理不同
斐林試劑是新配製的溶液,它在加熱條件下與醛基反應,被還原成磚紅色的沉澱,可用於鑒定可溶性還原糖的存在。用斐林試劑鑒定可溶性還原糖時,溶液的顏色變化過程為:淺藍色→棕色→磚紅色(沉澱)。
鑒定生物組織中是否含有蛋白質時,常用雙縮脲法,使用的是雙縮脲試劑,發生的是雙縮脲反應。雙縮脲反應實質是在鹼性環境下的與雙縮脲試劑發生的紫色反應。而蛋白質分子中含有很多與雙縮脲()結構相似的肽鍵,所以蛋白質都能與雙縮脲試劑發生顏色反應,可以用雙縮脲試劑鑒定蛋白質的存在。
(3)兩種試劑的保存方式不同。斐林試劑甲和斐林試劑乙可強烈產生,很容易沉澱析出,因此斐林試劑一般為現用現配;而班氏試劑的配方中,檸檬酸鈉為一對緩衝物質,產生的數量有限,與溶液混合后產生的濃度相對較低,不易析出,因此該試劑可長期保存。
當然,無論用班氏試劑還是斐林試劑,歸根結底都是與醛基在沸水浴加熱條件下反應而生成磚紅色的沉澱,兩者反應現象一樣,這就是二者的相同之處。
(4)備註:
如果溶液中還原糖含量較低,產生的氧化亞銅便會較少,試驗后只會有綠色、混濁的黃色或橙色等。
在酸性環境中,Cu2會變得較為穩定,不容易發生反應,所以不能進行試驗。
醇和醛在這測試亦會產生磚紅色沉澱物,因為兩者都具有在這試驗中產生作用的官能團。