酮基
酮基

酮基去氫表雄酮
‖
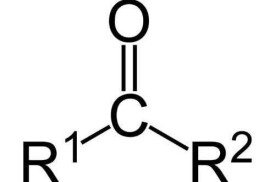
—C—
結構簡式:(—CO—)
使含該結構的有機物有還原性
如:草酸 HOOC—COOH
在生物中,另有專業名稱,羰基。
由一個 sp2或sp雜化(見雜化軌道)的碳原子與一個氧原子通過雙鍵(見化學鍵)相結合而成的基團,可以表示為:
關係式
羰基C=O的雙鍵的鍵長約1.22埃(公制長度單位,一億分之一厘米,常用以表示光波的波長及其他微小長度)。
由於氧的電負性(3.5)大於碳的電負性(2.5),C=O鍵的電子云分佈偏向於氧原子:
分佈示意圖
這個特點決定了羰基的極性和化學反應性。
構成羰基的碳原子的另外兩個鍵,可以單鍵或雙鍵的形式與其他原子或基團相結合而成為種類繁多的羰基化合物。羰基化合物可分為醛酮類和羧酸類兩類(R為烷基):
醛酮類:R─CH=O 醛
R─CO─R 酮
羧酸類:R─CO─OH 羧酸
R─CO─OR′ 羧酸酯
R─CO─O─CO─R′ 酸酐
R─CO─O─O─CO─R′ 醯基過氧化物
R─CO─NH2 醯胺
R─CO─X(X─F、Cl、Br、I) 醯鹵
R─CH─C─O 烯酮
R─N─C─O 異氰酸酯
由於碳原子和氧原子的電負性差別,羰基化合物容易與親核試劑發生親核加成反應。
羰基的性質很活潑,容易起加成反應,如與氫生成醇。
物理性質:具有強紅外吸收。
化學性質:由於氧的強吸電子性,碳原子上易發生親核加成反應。其它常見化學反應包括:親核還原反應,羥醛縮合反應。
反應:α-氫的反應
(1)羥醛縮合
在稀鹼或稀酸的作用下,兩分子的醛或酮可以互相作用,其中一個醛(或酮)分子中的α-氫加到另一個醛(或酮)分子的羰基氧原子上,其餘部分加到羰基碳原子上,生成一分子β-羥基醛或一分子β-羥基酮。這個反應叫做羥醛縮合或醇醛縮合(aldolcondensation)。通過醇醛縮合,可以在分子中形成新的碳碳鍵,並增長碳鏈。
羥醛縮合反應歷程,以乙醛為例說明如下:
第二步是這個負離子作為親核試劑,立即進攻另一個乙醛分子中的羰基碳原子,發生加成反應後生成一個中間負離子(烷氧負離子)。
第三步,烷氧負離子與水作用得到羥醛和OH。
稀酸也能使醛生成羥醛,但反應歷程不同。酸催化時,首先因質子的作用增強了碳氧雙鍵的極化,使它變成烯醇式,隨後發生加成反應得到羥醛。
生成物分子中的α-氫原子同時被羰基和β-碳上羥基所活化,因此只需稍微受熱或酸的作用即發生分子內脫水而生成,α,β-不飽和醛。
凡是α-碳上有氫原子的β-羥基醛、酮都容易失去一分子水。這是因為α-氫比較活潑,並且失水后的生成物具有共軛雙鍵,因此比較穩定。
除乙醛外,由其他醛所得到的羥醛縮合產物,都是在α-碳原子上帶有支鏈的羥醛或烯醛。羥醛縮合反應在有機合成上有重要的用途,它可以用來增長碳鏈,並能產生支鏈。
具有α-氫的酮在稀鹼作用下,雖然也能起這類縮合反應,但由於電子效應、空間效應的影響,反應難以進行,如用普通方法操作,基本上得不到產物。一般需要在比較特殊的條件下進行反應。例如:丙酮在鹼的存在下,可以先生成二丙酮醇,但在平衡體系中,產率很低。如果能使產物在生成后,立即脫離鹼催化劑,也就是使產物脫離平衡體系,最後就可使更多的丙酮轉化為二丙酮醇,產率可達70%~80%。二丙酮醇在碘的催化作用下,受熱失水后可生成α,β-不飽和酮。
在不同的醛、酮分子間進行的縮合反應稱為交叉羥醛縮合。如果所用的醛、酮都具有α-氫原子,則反應后可生成四種產物,實際得到的總是複雜的混合物,沒有實用價值。一些不帶α-氫原子的醛、酮不發生羥醛縮合反應(如HCHO、RCCHO、ArCHO、RCCOCR、ArCOAr、ArCOCR等),可它們能夠同帶有α-氫原子的醛、酮發生交叉羥醛縮合,其中主要是苯甲醛和甲醛的反應。並且產物種類減少,可以主要得到一種縮合產物,產率也較高。反應完成之後的產物中,必然是原來帶有α-氫原子的醛基被保留。在反應時始終保持不含α-氫原子的甲醛過量,便能得單一產物。芳香醛與含有α-氫原子的醛、酮在鹼催化下所發生的羥醛縮合反應,脫水得到產率很高的α,β-不飽和醛、酮,這一類型的反應,叫做克萊森-斯密特(Claisen-Schmidt)縮合反應。在鹼催化下,苯甲醛也可以和含有α-氫原子的脂肪酮或芳香酮發生縮合。另外,還有些含活潑亞甲基的化合物,例如丙二酸、丙二酸二甲酯、α-硝基乙酸乙酯等,都能與醛、酮發生類似於羥醛縮合的反應。
(2)烴基上的鹵代反應
由於羰基強烈的吸電子作用,醛、酮的α-氫原子容易被鹵素取代,生成α-鹵代醛、酮。
這類反應可以被酸或鹼催化。用酸催化時,可通過控制反應條件(例如酸和鹵素的用量,反應溫度等),使所得的產物主要是一鹵代物,二鹵代物或三鹵代物。
決定整個反應速度的步驟是生成烯醇的步驟,即取決於丙酮和酸的濃度,而與鹵素的濃度無關。
生成的一鹵代物繼續與鹵素反應的速度降低。這是由於鹵素原子電負性很大,使一鹵代物烯醇式雙鍵上的電子云密度降低,因而與鹵素的親電加成難以進行。所以酸催化鹵代反應常停止在一鹵代產物上。
鹼催化的鹵代反應中決定整個反應速度的步驟是生成負碳離子(烯醇負離子)的步驟,即反應速度與丙酮和鹼的濃度有關,與鹵素的濃度無關。
用鹼催化時,則因反應速度很快,一般不能使反應控制在生成一鹵代物或二鹵代物階段。這是因為當一個鹵素原子引入α-碳原子以後,由於鹵素是吸電子的,使得α-氫原子更加活潑,形成新的負碳離子更加容易,形成的負碳離子更加穩定,因此⑴式反應更快,這就是鹼催化難以控制在一鹵代物的原因。
凡結構式為CH3-C==O的醛或酮(乙醛和甲基酮)與次鹵酸或鹵素鹼溶液作用時,甲基上的三個α-氫原子都被鹵素原子取代,生成三鹵代衍生物。而這種三鹵代衍生物,由於鹵素的強吸電子誘導效應,使碳的正電性大大加強,在鹼的存在下,發生碳碳鍵的斷裂,分解生成三鹵甲烷(俗稱鹵仿)和羧酸鹽。因此,通常把次鹵酸鈉的鹼溶液與乙醛或甲酮作用,α-甲基的三個氫原子都被鹵素原子取代,生成的三鹵衍生物在受熱時,其碳碳鍵斷裂,生成鹵仿和羧酸鹽的反應稱為鹵仿反(haloformareaction)。由於次鹵酸鈉是一個氧化劑,它可以使具有-CHOH-CH3結構的醇氧化變成為含-COCH3結構的醛或酮。因此,凡含有-CHOH-CH3結構的醇也都能發生鹵仿反應。
如果用次碘酸鈉(碘加氫氧化鈉)作試劑,生成難溶於水的且具有特殊臭味黃色結晶碘仿(CHI)的反應稱為碘仿反應。
甲基酮的鹵仿反應是製備羧酸的一個途徑。另外,由於次鹵酸鹽對於雙鍵沒有干擾,所以一些不飽和的甲基酮也可以通過鹵仿反應轉變為相應的羧酸。
:羰基(酮基)的親核加成反應
羰基中的π鍵和碳碳雙鍵中的π鍵相似,也易斷裂,因此與碳碳雙鍵類似,羰基也可以通過斷裂π鍵而發生加成反應。與碳碳雙鍵不同的是,由於羰基氧原子的電負性比碳原子大,易流動的π電子被強烈地拉向氧原子,所以羰基的氧原子是富電子的,以致氧原子帶部分負電荷,羰基的碳原子是缺電子的,使碳原子帶部分正電荷(),所以羰基是一個極性基團,具有一定的偶極矩,偶極矩的方向由碳指向氧,使得羰基具有兩個反應中心,在碳原子上呈現正電荷中心,在氧原子上呈現負電荷中心。一般地講,帶部分正電荷的碳原子比帶負電荷的氧原子具有更大的化學反應活性。因此,與碳碳雙鍵易於發生親電加成反應不同,碳氧雙鍵最易發生被親核試劑進攻的親核加成反應。一般是親核試劑(NuA)的親核部分(Nu)首先向羰基碳原子進攻,其次帶正電荷的親電部分(A)加到羰基的氧原子上。所以,羰基的典型反應是親核加成反應。
(1)與氫氰酸的加成
醛、酮與氫氰酸發生加成反應生成α-羥基腈(又叫氰醇)。
羰基與氫氰酸的加成反應在有機合成上很有用,是增長碳鏈的方法之一。羥基腈是一類活潑化合物,易於轉化成其他化合物,因而是有機合成中間體。例如,α-羥基腈可以水解成α-羥基酸,α-羥基酸進一步失水,變成α,β-不飽和酸。
丙酮與氫氰酸在氫氧化鈉的水溶液中反應,生成丙酮氰醇,後者在硫酸存在下與甲醇作用,即發生水解、酯化、脫水反應,氰基變成甲氧醯基,最後生成甲基丙烯酸甲酯。甲基丙烯酸甲酯聚合生成聚甲基丙烯酸甲酯,即有機玻璃。
醛、酮與氫氰酸加成時,雖然可以直接用氫氰酸作反應試劑,但是它極易揮發,且毒性很大,所以操作要特別小心,需要在通風櫥內進行。為了避免直接使用氫氰酸,常將醛、酮與氰化鉀或氰化鈉的水溶液混合,然後緩緩加入硫酸來製備氰醇,這樣可以一邊產生HCN,一邊進行反應;也可以先將醛、酮與亞硫酸氫鈉反應,再與氰化鈉反應製備氰醇。
(2)與格氏試劑的加成
在格氏試劑中,可以把R看作是負碳離子(R),它所起的作用與CN、OH、RO等相似。由於負碳離子的親核性很強,所以格氏試劑可以和大多數醛、酮發生加成反應,生成碳原子更多的、具有新碳架的醇。
格氏試劑與甲醛作用生成伯醇,與其他醛作用生成仲醇,而格氏試劑與酮作用則生成叔醇。但當酮分子中的兩個烴基和格氏試劑中的烴基體積都很大時,格氏試劑對羰基的加成可因空間位阻增加而大大減慢,相反卻使副反應變得重要了,如空間位阻較大的二異丙基酮與叔丁基溴化鎂加成時則有兩種副反應產生,一種是二異丙基酮烯醇化得烯醇的鎂化物。另一種副反應是羰基被還原成仲醇,格氏試劑中的烴基失去氫變成烯烴。在這種情況下,用活性更強的有機鋰化合物代替格氏試劑,仍能得到加成產物,而且產率較高,並易分離。有機鋰化合物和醛、酮反應的方式和與格氏試劑相似。例如和醛、酮反應,則分別得到仲醇或叔醇。與格氏試劑不同之處是,有機鋰化合物和空間位阻較大的酮加成時,仍以加成產物為主。由於格氏試劑是活性很大的試劑,所以反應的第一步,即格氏試劑與羰基加成這一步,必須要在絕對無水的條件下進行反應。一般用經過乾燥處理的乙醚作溶劑,極其微量的水存在都會導致反應的失敗。
(3)與醇的加成
常溫下羰基可與羥基發生可逆反應,生成半縮醛、半縮酮:
C=O+HOR ==== C(OR)(OH)
在有Lewis酸存在時,反應可進一步發生生成縮醛、縮酮:
C(OR)(OH)+HOR ====C(OR)2
此反應可用於羰基的保護