微管蛋白
tubulin組成微管的蛋白質
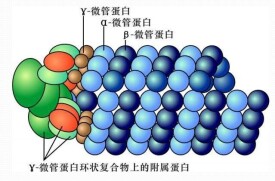
tubulin組成微管的蛋白質稱為微管蛋白。微管蛋白是球形分子,有兩種類型:α微管蛋白(α-tubulin)和β微管蛋白(β-tubulin),這兩種微管蛋白具有相似的三維結構,能夠緊密地結合成二聚體,作為微管組裝的亞基。α亞基由450個氨基酸組成,β亞基是由455個氨基酸組成,它們的分子量約55 kDa。近年來人們又發現了γ微管蛋白,該蛋白定位於微管組織中心(microtubule organizing center, MTOC),對微管的形成、微管的數量和位置、微管極性的確定以及細胞分裂起到重要作用。
這兩種亞基有35~40%的氨基酸序列同源,表明編碼它們的基因可能是由同一原始祖先演變而來。另外,這兩種微管蛋白與細菌中一種叫作FtsZ的GTPase(分子量為40kDa)同源,這種酶具有和微管蛋白相似的功能,能夠聚合併且參與細胞分裂。α和β微管蛋白的亞基都是直徑為4nm的球形分子,它們組成的異源二聚體的長度為8nm。α和β微管蛋白各有一個GTP結合位點,位於α亞基上的GTP結合位點,是不可逆的結合位點,結合上去的GTP不能被水解,也不能被GDP替換。位於β亞基上的GTP結合位點結合GTP后能夠被水解成GDP,所以這個位點又稱為可交換的位點(exchangeable site,E位點)。還有一種微管蛋白,即γ微管蛋白,不是微管的組成成分,但是參與微管的組裝。長期以來,Tubulin一直被認為是真核生物特異性的。然而,最近,已顯示幾種原核蛋白與微管蛋白有關。
系一種球蛋白,是細胞內微管的基本結構單位。它是由兩個蛋白質分子,即α-、β-微管蛋白分子聚合而成的異二聚體;每個這樣的二聚體又與兩個核苷酸分子相結合,一個是緊密結合,另一個為疏鬆結合,而且可以快速交換。分子量12萬,沉降係數6s。微管蛋白有兩個尺寸相等而結構不同的亞基(α和β)。其亞基分子量為5.5萬。微管蛋白具有專一性地與某些抗有絲分裂藥劑,如秋水仙鹼(colchicine)、長春花鹼和鬼臼素等相結合。一旦與秋水仙鹼相結合后就阻止了α-、β-微管蛋白(亞單位)聚合成微管蛋白質,從而完全失去形成微管的功能。微管蛋白對於保持細胞形狀、運動、胞內物質運輸起到了不可或缺的作用。
為了形成微管,α-和β-微管蛋白的二聚體與GTP結合併在GTP結合狀態下組裝到微管的(+)末端。β-微管蛋白亞基暴露在微管的正端,而α-微管蛋白亞基暴露在負端。在將二聚體摻入微管后,與β-微管蛋白亞基結合的GTP分子最終通過沿著微管原絲的二聚體間接觸水解成GDP。微管蛋白二聚體的β-微管蛋白成員是否與GTP或GDP結合會影響微管中二聚體的穩定性。與GTP結合的二聚體傾向於組裝成微管,而與GDP結合的二聚體傾向於分裂;因此,這種GTP循環對於微管的動態不穩定性是必不可少的。
當結合到微管中時,微管蛋白積累了許多翻譯后修飾,其中許多是這些蛋白質所特有的。這些修改包括detyrosination,乙醯化,polyglutamylation,polyglycylation,磷酸化,泛素化,SUMO化,和棕櫚醯化。對一些微管中的乙醯化進行了許多科學研究,特別是α-微管蛋白N-乙醯轉移酶(ATAT1),它被證明在許多生物和分子功能中發揮重要作用,它與許多人類疾病相關,特別是神經系統疾病。
在Prosthecobacter屬細菌中鑒定了α-和β-微管蛋白的同系物。它們被命名為BtubA和BtubB,以將它們鑒定為細菌微管蛋白。兩者都表現出與α-和β-微管蛋白的同源性。雖然結構上與真核生物微管蛋白高度相似,但它們具有幾個獨特的特徵,包括伴侶免疫摺疊和弱二聚化。電子低溫顯微鏡表明BtubA/B形式的微管體內,並表明這些微管包括只有五個原絲,而相比之下,真核微管,其通常含有13隨後體外研究表明,BtubA/B形成四鏈“微型微管”。
微管蛋白超家族含有六個微管蛋白(α-,β-,γ-,δ-,ε-和ζ-微管蛋白)。
α-微管蛋白
人α-微管蛋白亞型包括:
TUBA1A
TUBA1B
TUBA1C
TUBA3C
TUBA3D
TUBA3E
TUBA4A
TUBA8
β-微管蛋白
已知與人微管蛋白結合的所有藥物都與β-微管蛋白結合。這些包括紫杉醇,秋水仙鹼和長春花生物鹼,它們各自在β-微管蛋白上具有不同的結合位點。
III類β微管蛋白是微管元件中只表示神經元,並且是特定於神經組織神經元流行標識符。它比其他同種型的β-微管蛋白更慢地結合秋水仙鹼。
β1-微管蛋白,有時稱為VI類β-微管蛋白,在氨基酸序列水平上最不同。它僅在人類的巨核細胞和血小板中表達,並且似乎在血小板的形成中起重要作用。當VI類β-微管蛋白在哺乳動物細胞中表達時,它們會導致微管網路的破壞,微管碎片的形成,並最終導致巨核細胞和血小板中存在邊緣帶狀結構。
Katanin是一種蛋白質複合物,可在β-微管蛋白亞基上切斷微管,是神經元和高等植物中快速微管運輸所必需的。
人β-微管蛋白亞型包括:
TUBB
TUBB1
TUBB2A
TUBB2B
TUBB2C
TUBB3
TUBB4
TUBB4Q
TUBB6
γ-微管蛋白
γ-微管蛋白,微管蛋白家族的另一成員,在微管的成核和極性取向中是重要的。它主要存在於中心體和紡錘極體中,因為它們是最豐富的微管成核區域。在這些細胞器中,在稱為γ-微管蛋白環複合物(γ-TuRCs)的複合物中發現了幾種γ-微管蛋白和其他蛋白質分子,其在化學上模擬微管的(+)末端,從而允許微管結合。γ-微管蛋白也被分離為二聚體並且作為γ-微管蛋白小複合物(γTuSC)的一部分,在二聚體和γTuRC之間的中間尺寸。γ-微管蛋白是微管成核的最佳理解機制,但某些研究表明,某些細胞可能能夠適應其缺失,正如已經抑制其正確表達的突變和RNAi研究所表明的那樣。
人γ-微管蛋白亞型包括:
TUBG1
TUBG2
γ-微管蛋白環複合物的成員:
TUBGCP2
TUBGCP3
TUBGCP4
TUBGCP5
TUBGCP6
δ和ε-微管蛋白
已經發現Delta(δ)和epsilon(ε)微管蛋白定位於中心粒並且可能在中心粒結構和功能中起作用,儘管它們都沒有像α-和β-形式那樣被充分研究。
人δ-和ε-微管蛋白基因包括:
δ微管蛋白
TUBD1
ε微管蛋白
TUBE1
ζ-微管蛋白
Zeta-微管蛋白存在於許多真核生物中,但是其他人缺失,包括胎盤哺乳動物。已經顯示它與多中心上皮細胞中的中心粒的基底組結構相關。
BtubA / B
幾乎所有細菌和古細菌都使用FtsZ進行分裂。這是第一個鑒定出的原核細胞骨架蛋白。
經開區在發現euryarchaeal的進化枝Methanomicrobia和嗜鹽菌,在那裡它有細胞形狀分化功能。